Содержание
- 2. Дисперсные системы - это гетерогенные системы из двух и более веществ с сильно развитой поверхностью раздела
- 3. Дисперсные системы состоят как минимум из двух компонентов: Дисперсионной среды, которая играет роль растворителя и, следовательно,
- 4. Классификация По агрегатному состоянию дисперсионной среды и дисперсной фазы 1. Газ 2. Жидкость 3. Твердое вещество
- 5. Дисперсная среда: ГАЗ Дисперсная фаза: ГАЗ Всегда гомогенная смесь (воздух, природный газ)
- 6. Дисперсная фаза: Жидкость Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей, аэрозоли
- 7. Дисперсная фаза: Твёрдое вещество Пыли в воздухе, дымы, смог, пыльные и песчаные бури
- 8. Дисперсная среда: Твёрдое вещество Дисперсная фаза: ГАЗ Снежный наст с пузырьками воздуха в нём, почва, кирпич
- 9. Дисперсная фаза: Жидкость Влажная почва, медицинские и косметические средства (мази, тушь, помада и т.д.)
- 10. Дисперсная фаза: Твёрдое вещество Горные породы, цветные стёкла, некоторые сплавы
- 11. Классификация дисперсных систем и растворов Дисперсные системы: Взвеси (Грубодисперсные системы) Эмульсии Суспензии Аэрозоли 2. Коллоидные системы
- 12. Грубодисперсные системы – это дисперсные системы с размером частиц дисперсной фазы более 100 нм 1. Эмульсии
- 13. 2. Суспензии (жидкая среда и твердая фаза). Пример: кисель цементный раствор
- 14. 3. Аэрозоли (газовая среда и жидкая или твердая фаза). Пример: туман смерч
- 15. Коллоидные системы – Это дисперсные системы с размером частиц дисперсной фазы от 100 до 1 нм.
- 16. 2. Золи (твердая или жидкая среда и твердая фаза). Пример: сплавы минералы
- 17. Характеристика коллоидов: Для коллоидных систем характерно интенсивное броуновское движение частиц дисперсной фазы. По степени взаимодействия между
- 18. Эффект Тиндаля Рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде
- 19. Коллоидные системы в организме. Можно смело сказать, что весь человек – это коллоид, а все органы
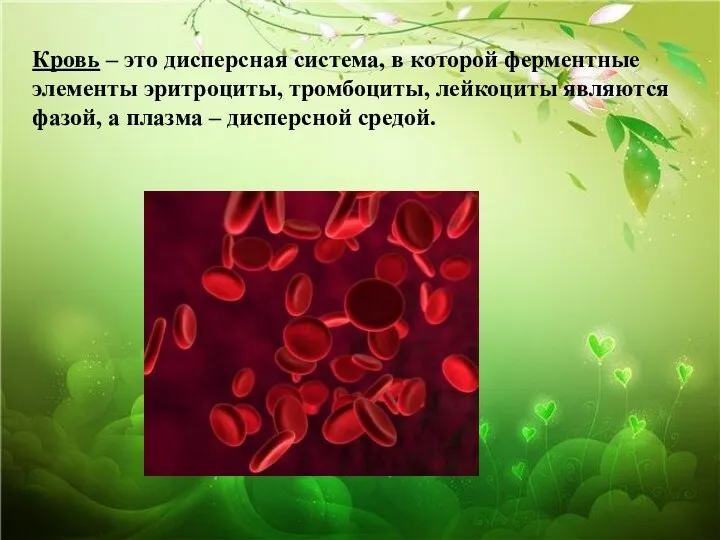
- 20. Кровь – это дисперсная система, в которой ферментные элементы эритроциты, тромбоциты, лейкоциты являются фазой, а плазма
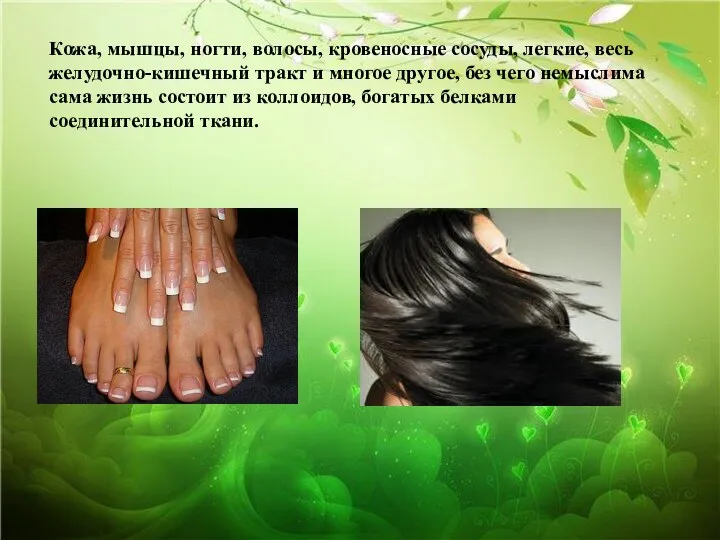
- 21. Кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима
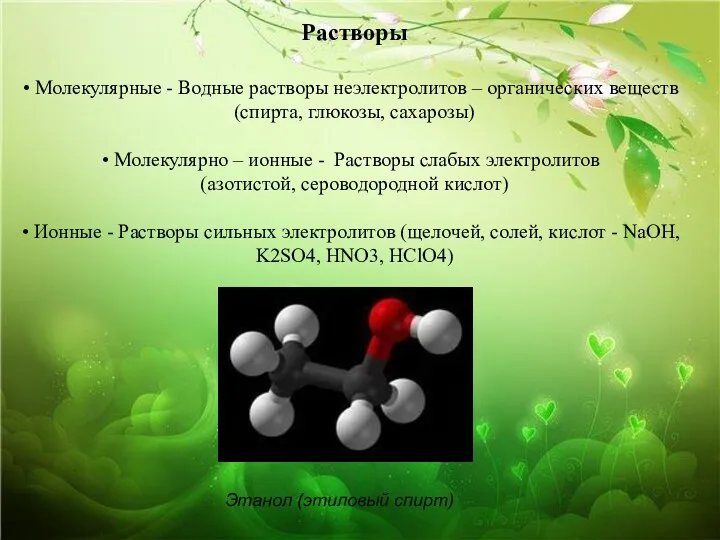
- 22. Растворы Молекулярные - Водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы) Молекулярно – ионные -
- 24. Скачать презентацию


















 Релейная защита и автоматика на ПТК Ретом 61 и Ретом 21
Релейная защита и автоматика на ПТК Ретом 61 и Ретом 21 Комплексна проробка рейсу Марсель (Франція) – Ломе (Того) під час перевезення вантажів у контейнерах
Комплексна проробка рейсу Марсель (Франція) – Ломе (Того) під час перевезення вантажів у контейнерах 01.09.11 4-ХМ
01.09.11 4-ХМ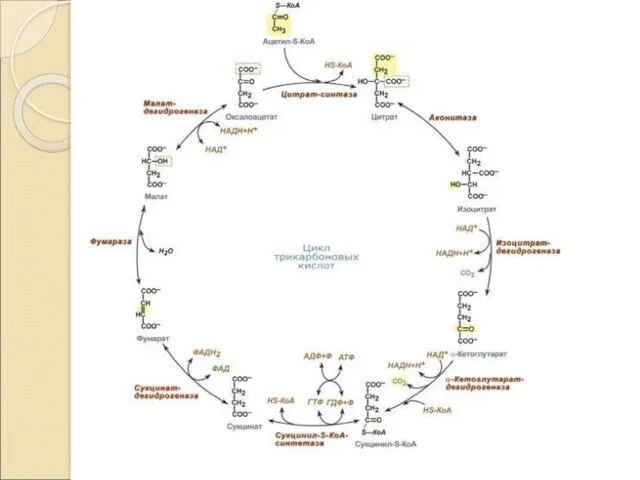 Основная роль ЦТК
Основная роль ЦТК Интегрированный урок по английскому языку и физической культуре. 3 класс
Интегрированный урок по английскому языку и физической культуре. 3 класс Interaktivnaya_igra_Den_rossiyskoy_nauki
Interaktivnaya_igra_Den_rossiyskoy_nauki Учебно - методический материал : Прогулки по Металлострою
Учебно - методический материал : Прогулки по Металлострою Боже, хочу я следовать за тобой
Боже, хочу я следовать за тобой Топырақ өңдеуді минимализациялау арқылы күріш және әртараптандыру дақылдарын өсірудің су, ресурс үнемдеу технологиясы
Топырақ өңдеуді минимализациялау арқылы күріш және әртараптандыру дақылдарын өсірудің су, ресурс үнемдеу технологиясы Клапанный привод с нижним расположением распределительного вала. Вихревой насос на судне
Клапанный привод с нижним расположением распределительного вала. Вихревой насос на судне Методы сведения балансов производственного пара. Причины возникновения дебалансов
Методы сведения балансов производственного пара. Причины возникновения дебалансов Военная топография. Изучение рельефа местности на карте (Занятие №1)
Военная топография. Изучение рельефа местности на карте (Занятие №1) роль семьи в воспитании ребенка
роль семьи в воспитании ребенка Кто Я. Личная эффективность
Кто Я. Личная эффективность Кардиогенный шок
Кардиогенный шок Организация ЭВМ и систем
Организация ЭВМ и систем Science Slam. Новый формат интеллектуального досуга
Science Slam. Новый формат интеллектуального досуга Диоды и их виды
Диоды и их виды Интернет-заказ текстиля от производителя
Интернет-заказ текстиля от производителя Тренировочная работа №4 по информатике. 11 класс
Тренировочная работа №4 по информатике. 11 класс презентация рисунков 6а и 6 б
презентация рисунков 6а и 6 б Древняя Спарта
Древняя Спарта Рекомендации и советы родителям четвероклассников.
Рекомендации и советы родителям четвероклассников. Стили речи: разговорный стиль
Стили речи: разговорный стиль Электроизмерительные приборы
Электроизмерительные приборы Антуан де Сент-Экзюпери Маленький принц 1943 год
Антуан де Сент-Экзюпери Маленький принц 1943 год Анализ мероприятий по обеспечению экологической безопасности
Анализ мероприятий по обеспечению экологической безопасности Инструкция по заполнению Личного кабинета (ЛК) студента
Инструкция по заполнению Личного кабинета (ЛК) студента