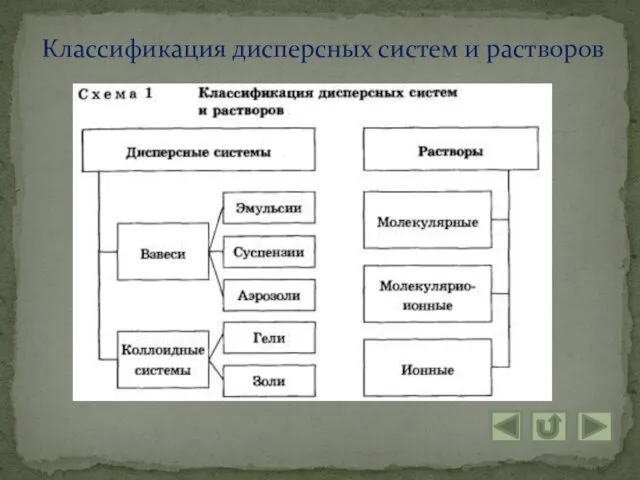
Коллоидные системы – это такие дисперсные системы, в которых размер частиц
фазы от 100 до 1 нм.
1. Коллоидные растворы, или золи: большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма и т. д.) и живого организма в целом
(кровь, лимфа, тканевая жидкость и т. д.).
Эффект Тиндаля: раствор отличают по образующейся “светящейся дорожке” – конусу при пропускании через них луча света.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит.
2. Гели или студни: представляют собой студенистые осадки, образующиеся при коагуляции золей.
Понятие коллоидной системы









 Любимые места моего района
Любимые места моего района Тренажер. Задание 20 ЕГЭ по русскому языку
Тренажер. Задание 20 ЕГЭ по русскому языку Русский модерн
Русский модерн Нейровизуализационные методы диагностики заболевании нервной системы
Нейровизуализационные методы диагностики заболевании нервной системы Фотоматериалы к проекту Путешествие по Золотому кольцу России Диск
Фотоматериалы к проекту Путешествие по Золотому кольцу России Диск Рекомендации по работе с родителями
Рекомендации по работе с родителями Характеристика, руководство, сопровождение сюжетно-ролевых игр
Характеристика, руководство, сопровождение сюжетно-ролевых игр История возникновения проблемы фирменного стиля
История возникновения проблемы фирменного стиля ИТ в сфере управления
ИТ в сфере управления ЕГЭ по русскому языку: выполнение тестовых заданий
ЕГЭ по русскому языку: выполнение тестовых заданий Субсидии на газификацию
Субсидии на газификацию Методика профессионального обучения
Методика профессионального обучения Угол. Измерение углов
Угол. Измерение углов акция засветись
акция засветись Childhood Education and References for Sustainable Education
Childhood Education and References for Sustainable Education Tattoo_salon
Tattoo_salon Джанни Родари, сказка Приключения Чиполлино
Джанни Родари, сказка Приключения Чиполлино Твой бюджет. Благоустройство детской площадки. Пулковский парк в Московском районе
Твой бюджет. Благоустройство детской площадки. Пулковский парк в Московском районе презентация Готовимся к школе
презентация Готовимся к школе Программа поэтапной работы над проектом
Программа поэтапной работы над проектом Мистецьке життя краю Тернопільщини
Мистецьке життя краю Тернопільщини Родительское собрание в 1 классе
Родительское собрание в 1 классе Игра Большая игра, посвященная юбилею пионерии.
Игра Большая игра, посвященная юбилею пионерии. Комбинационные логические устройства. Арифметико-логические устройства (АЛУ). Лекция 4
Комбинационные логические устройства. Арифметико-логические устройства (АЛУ). Лекция 4 Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Автоматизация процесса пропарки и пропитки древесной щепы в производстве ХТММ
Автоматизация процесса пропарки и пропитки древесной щепы в производстве ХТММ Выставка исследовательская деятельность
Выставка исследовательская деятельность Праздник Ильин день
Праздник Ильин день