Слайд 2

Ответить на вопросы
Какие вещества называют восстановителями? Что происходит с их степенью
окисления?
Приведите примеры важнейших восстановителей, из простых веществ и сложных веществ.
Отчего зависит восстановительные способности веществ?
Слайд 3

Ответить на вопросы
Какие вещества называют окислителями? Что происходит с их степенью
окисления при химических реакциях?
Какие вещества проявляют окислительные свойства? Приведите примеры.
От чего зависят окислительные свойства ?
Слайд 4

Ответить на вопросы
Назовите основные типы окислительно-восстановительных реакций.
Приведите примеры реакций:
а)
межмолекулярные,
б) внутримолекулярные,
в) диспропорционирования
Слайд 5

Выполнить упражнения
Выбрать из реакций окислительно-восстановительные, расставить степени окисления всех элементов,
определить тип окислительно - восстановительной реакции, указать окислитель и восстановитель.
Cu(OH)2 → CuO + H2O
Cu(NO3)2 → CuO + NO2 + O2
HNO2 → NO + NO2 + H2O
P + CI2 → PCI5
H2O + SO2 → H2SO3
Ca(OH)2 +CO2 → CaCO3 + H2O
Слайд 6
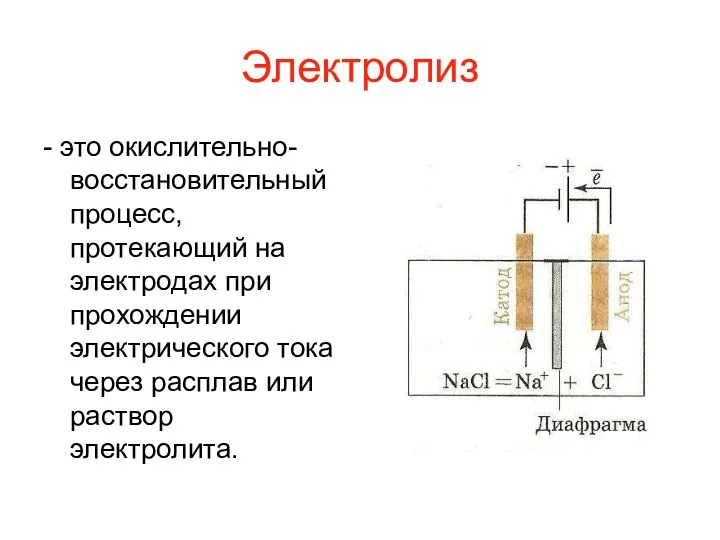
Электролиз
- это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока
через расплав или раствор электролита.
Слайд 7

Электролиз расплавов
Подвергаются: щелочи, термически устойчивые соли, оксиды металлов.
Слайд 8

Слайд 9

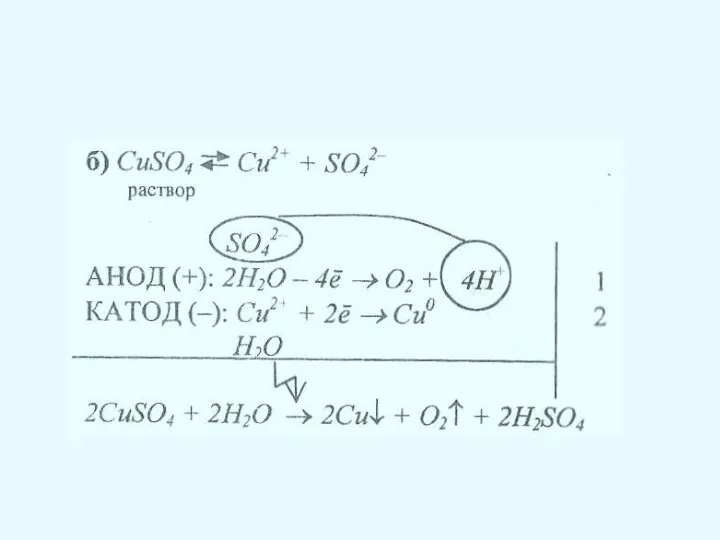
Электролиз растворов
Порядок разрядки анионов
В первую очередь разряжаются бескислородные ионы: S2-, I-,
Br-, CI- и анионы органических кислот 2RCOO- - 2e→ 2CO2 + R-R.
Во вторую очередь разряжается гидроксид-ион (в щелочной среде): 4OH- - 4e → O2 + 2H2O или вода (в кислой и нейтральной среде) 2H2O – 4e → O2 + 4H+.
В растворе не разряжаются анионы кислородсодержащих кислотных остатков и фторид-ион.
Слайд 10

Электролиз раствора
Порядок разрядки катионов
В первую очередь на катоде разряжаются катионы металлов,
стоящих в ряду напряжений металлов после водорода.
Во вторую очередь в кислотной среде разряжаются катионы водорода: 2H+ + 2e → H2 или вода (в нейтральной и щелочной среде) 2H2O+2e → H2+OH-
Одновременно с водой могут разряжаться катионы металлов стоящих в ряду напряжений от алюминия до водорода.
В растворах никогда не разряжаются катионы металлов, стоящих в ряду напряжений до алюминия (включительно).
Слайд 11

Слайд 12
Слайд 13













 Студенческий совет экономичесого факультета
Студенческий совет экономичесого факультета Принципы обследования больного в хирургической практике. Современные цифровые диагностические технологии в стоматологии
Принципы обследования больного в хирургической практике. Современные цифровые диагностические технологии в стоматологии Образовательные возможности информационных технологий
Образовательные возможности информационных технологий Пространственные конструкции покрытий зданий
Пространственные конструкции покрытий зданий ПРЕЗЕНТАЦИЯ ЛУКОЙЛ
ПРЕЗЕНТАЦИЯ ЛУКОЙЛ Проект по краеведению Мой отчий край ни в чём не повторим
Проект по краеведению Мой отчий край ни в чём не повторим Детерминированные модели
Детерминированные модели Расчет одиночных трубчатых колодцев (скважин)
Расчет одиночных трубчатых колодцев (скважин) Путешествие по материкам. Евразия
Путешествие по материкам. Евразия Стратегия организации
Стратегия организации презентация Добро пожаловать в интернат
презентация Добро пожаловать в интернат Tehnologii de confecţionare a produselor vestimentare
Tehnologii de confecţionare a produselor vestimentare Строение семян покрытосеменных растений
Строение семян покрытосеменных растений Творческий, информационно – практико-ориентированный проект Прошлое, настоящее, будущее родного края
Творческий, информационно – практико-ориентированный проект Прошлое, настоящее, будущее родного края Погода и климат
Погода и климат Презентация Победапо русскому языку во 2 классе с применением здоровьесберегающих технологий Сочетания ЖИ_ШИ
Презентация Победапо русскому языку во 2 классе с применением здоровьесберегающих технологий Сочетания ЖИ_ШИ Умножение рациональных чисел
Умножение рациональных чисел ПрезентацияСвященные сооружения
ПрезентацияСвященные сооружения Как человек реагирует на явления в жизни и искусстве
Как человек реагирует на явления в жизни и искусстве Сценарий спектакля Снежная королева
Сценарий спектакля Снежная королева Сказочные лабиринты игр Воскобовича
Сказочные лабиринты игр Воскобовича Технология приготовления и контроль качества блюд из дрожжевого теста. Инвентаризация материально-производственных запасов
Технология приготовления и контроль качества блюд из дрожжевого теста. Инвентаризация материально-производственных запасов Новітній маркетинг в фармації та його основні напрямки
Новітній маркетинг в фармації та його основні напрямки Верхнее строение пути. Устройство железнодорожного пути. Тема 1
Верхнее строение пути. Устройство железнодорожного пути. Тема 1 Города-герои
Города-герои Остров сокровищ
Остров сокровищ Лес - богатство наше
Лес - богатство наше Правила безопасности систем газораспределения и газопотребления. Надзор и обслуживание
Правила безопасности систем газораспределения и газопотребления. Надзор и обслуживание