Содержание
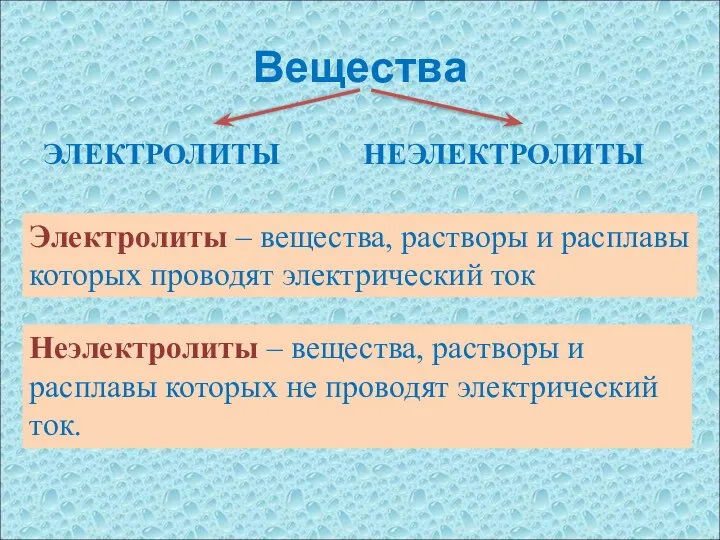
- 2. Вещества ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты –
- 3. Почему растворы электролитов проводят электрический ток? Сванте Аррениус (1859-1927) Создал теорию электролитической диссоциации. За исследования в
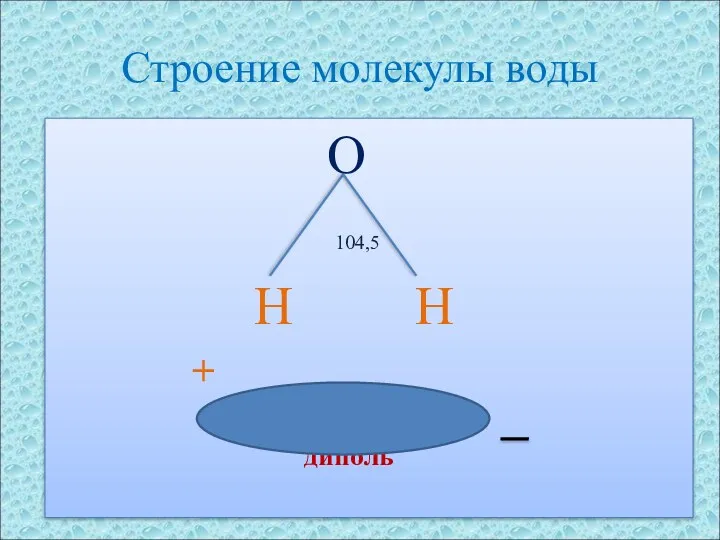
- 4. Строение молекулы воды O 104,5 H H + диполь
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 6. Легче всего диссоциируют вещества с ионной и ковалентной полярной связью: Кислоты : HCl, H2SO4, HF, HNO3
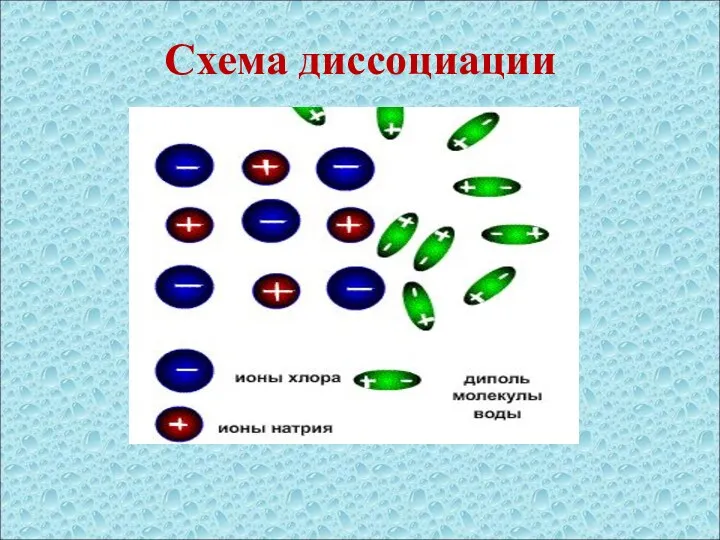
- 7. Последовательность процессов, происходящих при электролитической диссоциации: Ориентация молекул – диполей воды около ионов; Гидратация (взаимодействие) молекул
- 8. Схема диссоциации
- 9. Уравнение реакции: NaCl = Na+ + Cl- NaCl – молекула хлорида натрия Na+ - ион натрия
- 10. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
- 11. Степень диссоциации выражают в долях или процентах. При ά = 0 диссоциация отсутствует При ά =
- 12. Электролиты Сильные все растворимые соли; сильные кислоты H2SO4, HCl, HNO3 все щелочи NaOH, KOH Слабые слабые
- 14. Скачать презентацию








 Сложноподчиненные предложения
Сложноподчиненные предложения Методы и методические приемы обучения биологии
Методы и методические приемы обучения биологии Электродвигатели постоянного тока. Первый этап развития электродвигателя
Электродвигатели постоянного тока. Первый этап развития электродвигателя Булану мен конденсация
Булану мен конденсация Дерево тематик. Пассажиры
Дерево тематик. Пассажиры Этапы развития механизации ПРТС-работ. Организация погрузочно-разгрузочных, транспортных и складских работ
Этапы развития механизации ПРТС-работ. Организация погрузочно-разгрузочных, транспортных и складских работ Векторная графика в Web
Векторная графика в Web Презентация Коллекционирование как исследовательская практика ребёнка(Из опыта работы по программе А.И. Савенкова)
Презентация Коллекционирование как исследовательская практика ребёнка(Из опыта работы по программе А.И. Савенкова) деление десятичной дроби на натуральное число
деление десятичной дроби на натуральное число Типы климатов России разработка урока географии 8 класс
Типы климатов России разработка урока географии 8 класс Всероссийская олимпиада по искусству. Школьный этап. (9-11 класс)
Всероссийская олимпиада по искусству. Школьный этап. (9-11 класс) Рабочий отчет департамента аналитики компании IPO
Рабочий отчет департамента аналитики компании IPO There is, are
There is, are Презентация Виды современных велосипедов Диск
Презентация Виды современных велосипедов Диск Статистика посещения кинотеатров в России, 2009-2019 годы
Статистика посещения кинотеатров в России, 2009-2019 годы презентация результата совместного проекта с родителями
презентация результата совместного проекта с родителями Тест. Планеты Солнечной системы
Тест. Планеты Солнечной системы Презентации по основам православной культуры
Презентации по основам православной культуры Кодекс этической деятельности педагога
Кодекс этической деятельности педагога Развитие зрительного восприятия у детей с ОНР через игровую систему обучения
Развитие зрительного восприятия у детей с ОНР через игровую систему обучения Кітап оқуға баулу
Кітап оқуға баулу Летний профильный отряд по химии Волшебный мир химии
Летний профильный отряд по химии Волшебный мир химии Древняя Индия
Древняя Индия Ұлпа қабынуын емдеудің салыстырмалы сипаттамасы
Ұлпа қабынуын емдеудің салыстырмалы сипаттамасы Требования к хорошему кейсу
Требования к хорошему кейсу Как семейные традиции укрепляют семью
Как семейные традиции укрепляют семью Послеродовые гнойно-септические заболевания (перитонит, сепсис, токсико-инфекционный шок)
Послеродовые гнойно-септические заболевания (перитонит, сепсис, токсико-инфекционный шок) 7 класс: Население и страны Северной Америки
7 класс: Население и страны Северной Америки