Содержание
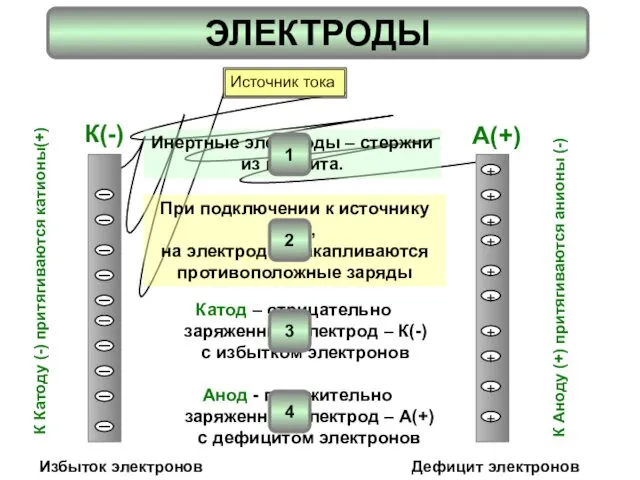
- 2. ЭЛЕКТРОДЫ I I I I I I I I I I + + + + +
- 3. Электролизу предшествует диссоциация На катоде К(-) протекает процесс восстановления На аноде А(+) – протекает процесс окисления
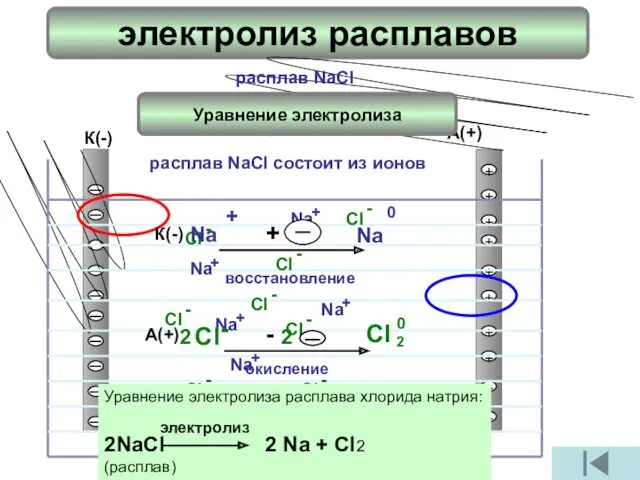
- 4. электролиз расплавов А(+) К(-) I I I I I I I I I I + +
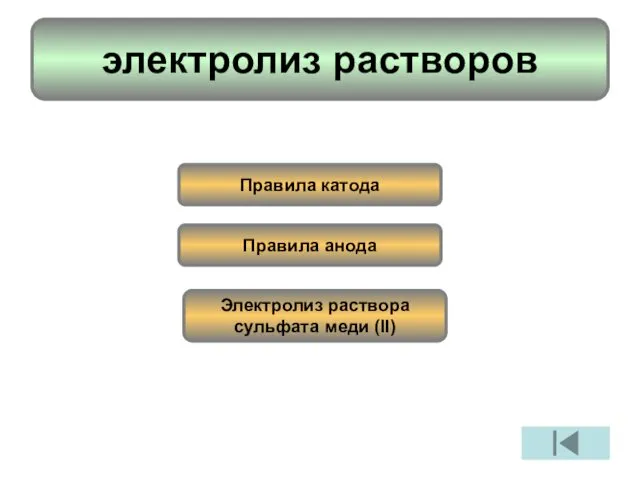
- 5. электролиз растворов Правила катода Правила анода Электролиз раствора сульфата меди (II)
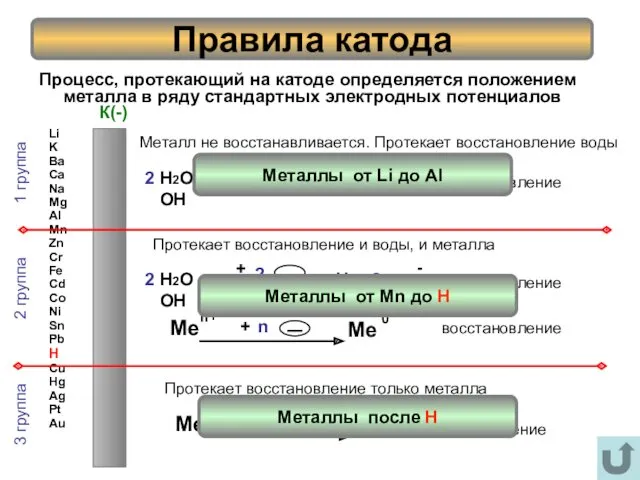
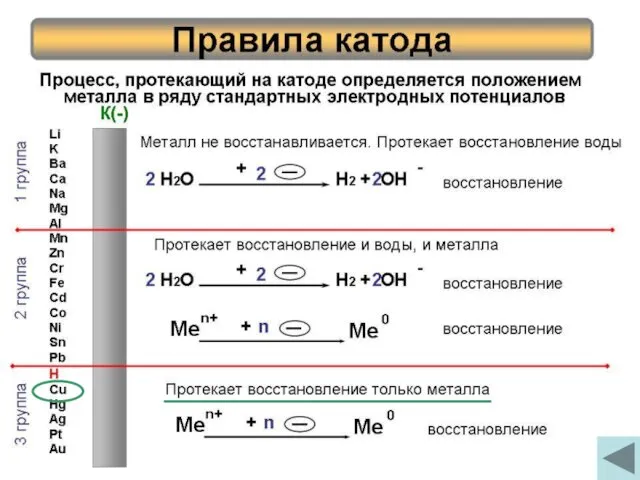
- 6. Процесс, протекающий на катоде определяется положением металла в ряду стандартных электродных потенциалов Правила катода Li K
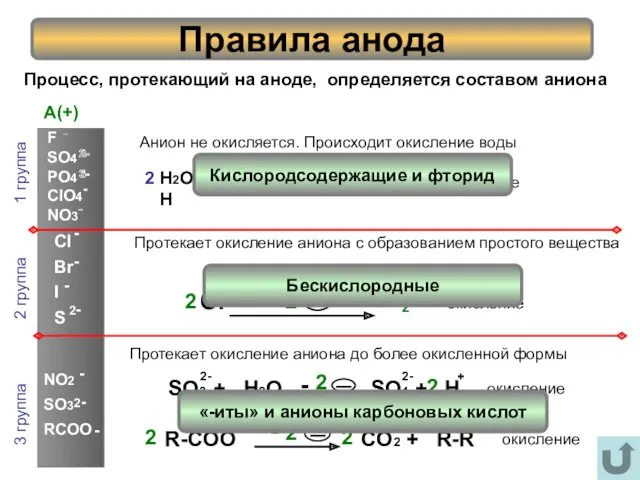
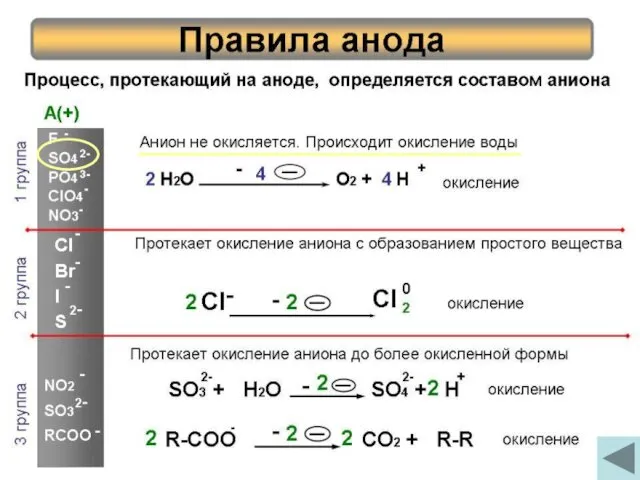
- 7. Процесс, протекающий на аноде, определяется составом аниона Правила анода 1 группа 2 группа 3 группа Анион
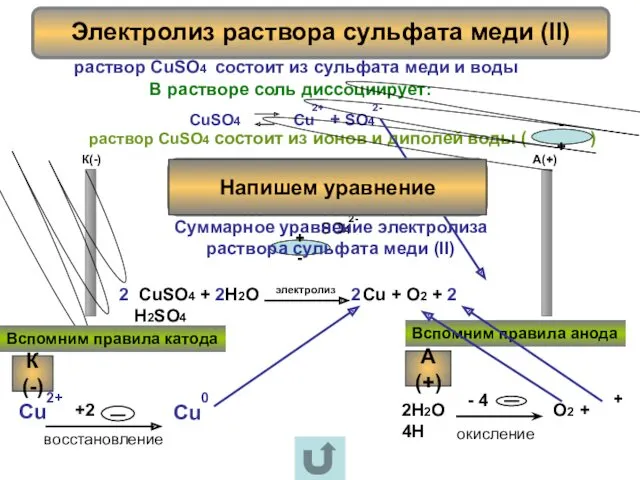
- 8. Электролиз раствора сульфата меди (II) раствор CuSO4 состоит из сульфата меди и воды + - +
- 11. Значение электролиза Получение активных металлов (щелочных, щелочно-земельных, алюминия) Получение простых веществ - неметаллов (H2, Br2, I2,
- 12. Решение заданий Задания по электролизу расплавов и растворов по спецификации КИМов ЕГЭ Блок В задание В4
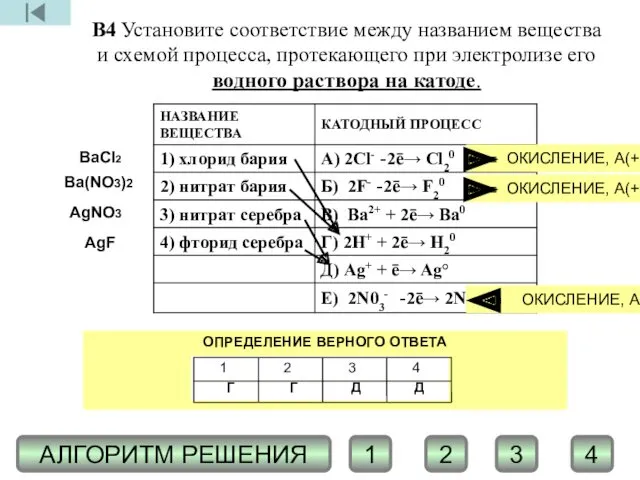
- 13. В4 Установите соответствие между названием вещества и схемой процесса, протекающего при электролизе его водного раствора на
- 15. Скачать презентацию



 Поражение суставов при иммунодефицитных состоянии
Поражение суставов при иммунодефицитных состоянии Реконструкция существующих одномодовых ВОЛС первичной сети
Реконструкция существующих одномодовых ВОЛС первичной сети МЕТАЛЛЫ
МЕТАЛЛЫ Пристрої цифрової обробки радіолокаційних сигналів (заняття № 2.5)
Пристрої цифрової обробки радіолокаційних сигналів (заняття № 2.5) Общее равновесие в международной торговле. Стандартная модель международной торговли (СММТ)
Общее равновесие в международной торговле. Стандартная модель международной торговли (СММТ) Искусственные материалы. Тонколистовой металл и проволока
Искусственные материалы. Тонколистовой металл и проволока Культурно-исторические особенности народов России
Культурно-исторические особенности народов России Виды термической обработки стали
Виды термической обработки стали Травмы. Переломы и вывихи
Травмы. Переломы и вывихи ДНК и РНК. Устройство генома
ДНК и РНК. Устройство генома Научающе-бихевиоральное направление Б.Ф. Скиннер
Научающе-бихевиоральное направление Б.Ф. Скиннер Туган төбәгебезнең экологик торышы.
Туган төбәгебезнең экологик торышы. Ангельское личико. Фабула или пересказ содержания. Жак Лурселль. Авторская энциклопедия фильмов
Ангельское личико. Фабула или пересказ содержания. Жак Лурселль. Авторская энциклопедия фильмов Презентация проекта Деревянная ложка
Презентация проекта Деревянная ложка Структурированная кабельная система (СКС)
Структурированная кабельная система (СКС) методическая разработка классного час по теме Толерантность
методическая разработка классного час по теме Толерантность Наволочка с клапаном. Обработка поперечных срезов наволочки
Наволочка с клапаном. Обработка поперечных срезов наволочки Викторина Африка
Викторина Африка Презентация к уроку Австралия (7 класс)
Презентация к уроку Австралия (7 класс) конспект урока по окружающему миру Воздух 1 класс
конспект урока по окружающему миру Воздух 1 класс Совершенствование перевозок пассажиров на линии метрополитена
Совершенствование перевозок пассажиров на линии метрополитена Тепловая карта ОМП 01.2024
Тепловая карта ОМП 01.2024 Виды трубопроводов
Виды трубопроводов Объекты - продолжение. Ценные бумаги и нематериальные блага
Объекты - продолжение. Ценные бумаги и нематериальные блага Звук и буква Ц
Звук и буква Ц В гостях у сказки
В гостях у сказки ВКР: Организация медницко-радиаторного участка на предприятии АТЦ АО Соликамский завод Урал
ВКР: Организация медницко-радиаторного участка на предприятии АТЦ АО Соликамский завод Урал Организация методической помощи студентам по написанию ВКР. Требования к ВКР
Организация методической помощи студентам по написанию ВКР. Требования к ВКР