Содержание
- 2. Взаимное влияние атомов в молекуле может осуществляться по системе σ-связей (индуктивный эффект), по системе π-связей (мезомерный
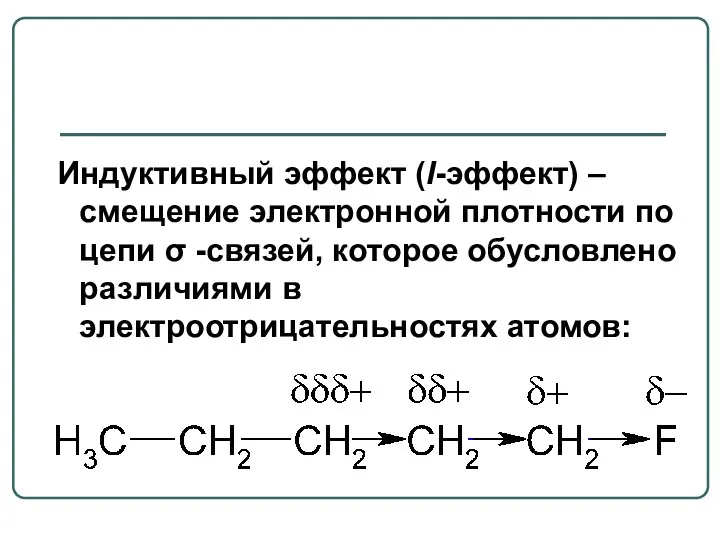
- 3. Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи σ -связей, которое обусловлено различиями в электроотрицательностях
- 4. Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более ЭО
- 5. –I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br,
- 6. +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (-Mg, -Li); насыщенные углеводородные радикалы (-CH3,
- 7. Мезомерный эффект – смещение электронной плотности по цепи сопряженных π-связей. Возникает только при наличии сопряжения связей.
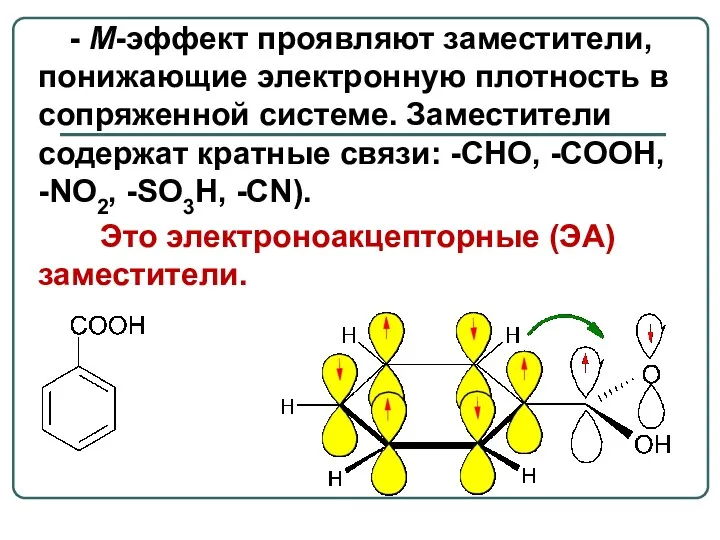
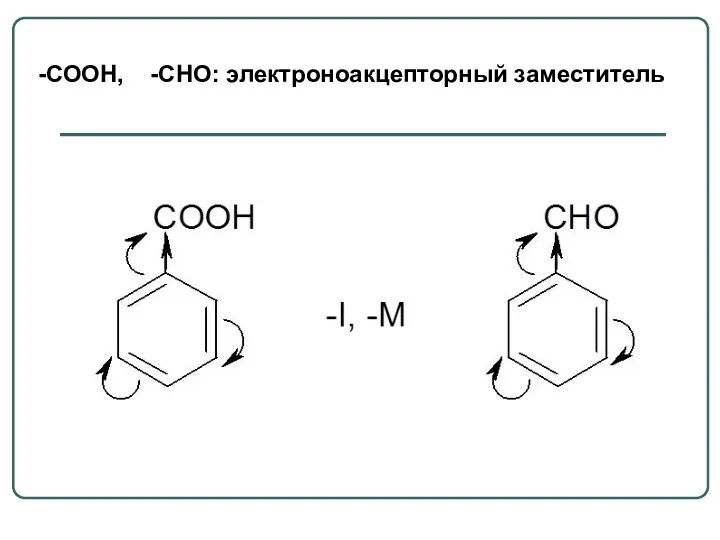
- 8. - М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH,
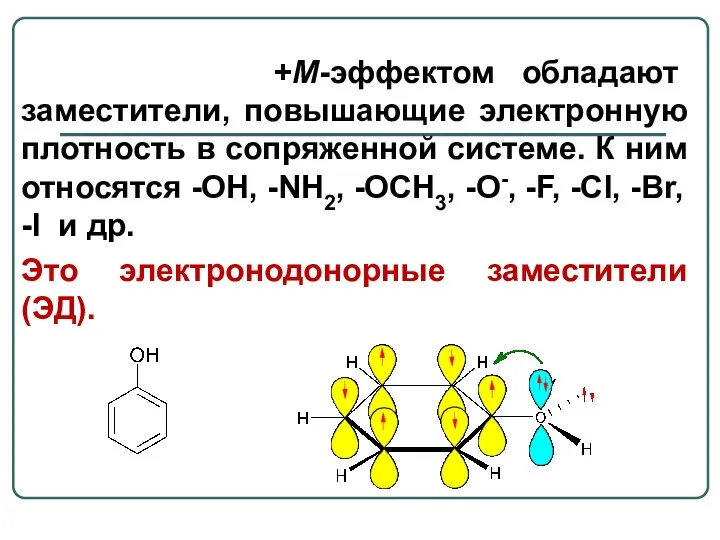
- 9. +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся -OH, -NH2, -OCH3, -O-,
- 10. В молекулах органических соединений индуктивный и мезомерный эффекты заместителей, действуют одновременно.
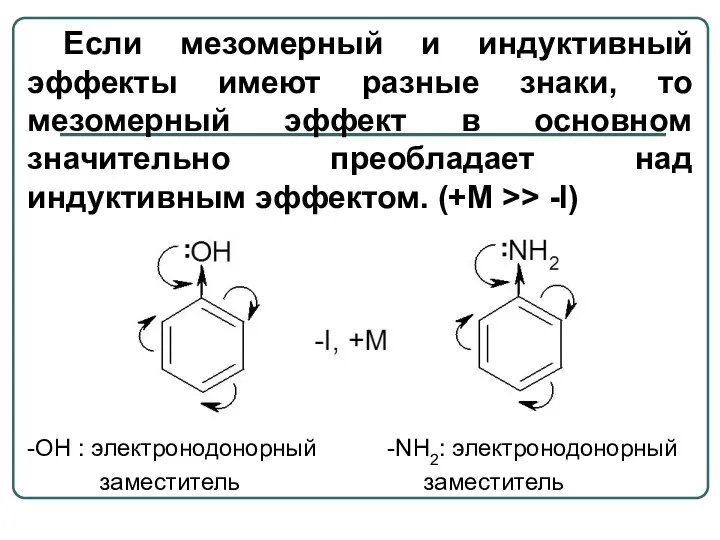
- 11. Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над
- 12. -СООН, -СНО: электроноакцепторный заместитель
- 13. Таким образом, учитывая перераспределение электронной плотности в молекулах органических соединений можно прогнозировать их свойства.
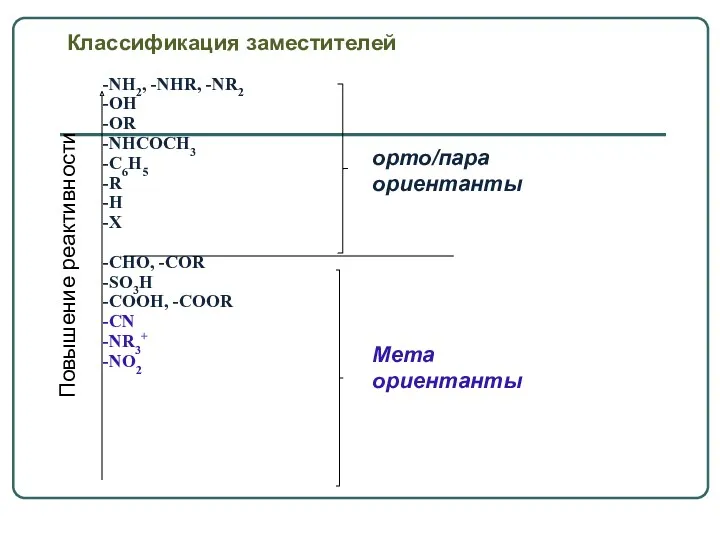
- 14. Классификация заместителей -NH2, -NHR, -NR2 -OH -OR -NHCOCH3 -C6H5 -R -H -X -CHO, -COR -SO3H -COOH,
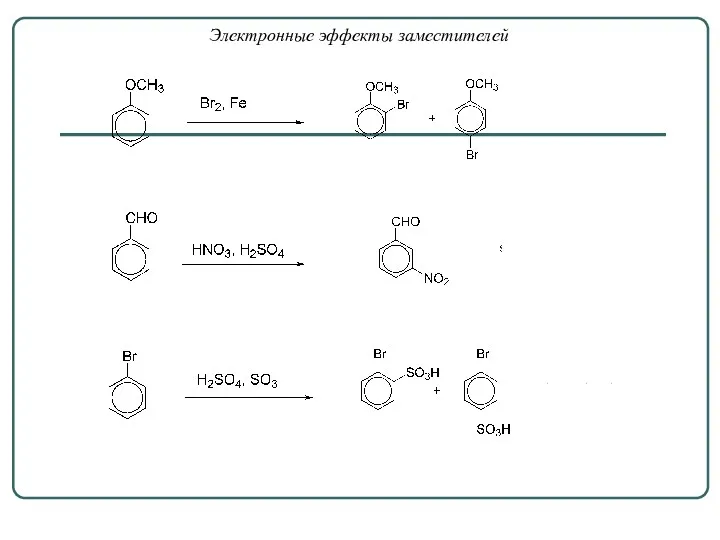
- 15. Электронные эффекты заместителей
- 16. 1. Общая характеристика спиртов. 2. Одноатомные спирты: физические и химические свойства, способы получения. 3. Многоатомные спирты.
- 17. 1. Общая характеристика спиртов. Номенклатура, классификация, изомерия.
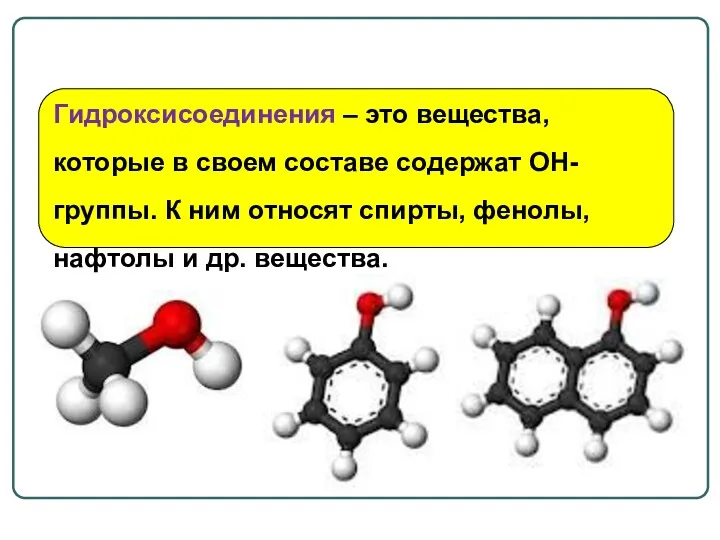
- 18. Гидроксисоединения – это вещества, которые в своем составе содержат OH-группы. К ним относят спирты, фенолы, нафтолы
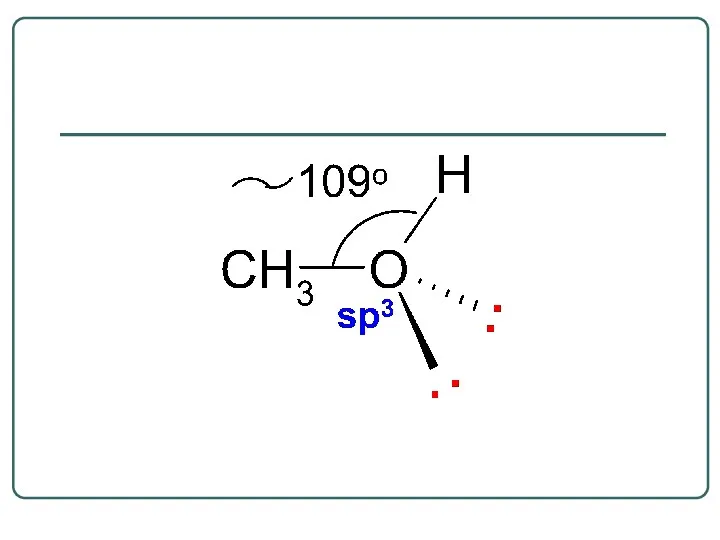
- 19. Спирты – это гидроксисоединения, в молекулах которых OH-группы связаны с насыщенным атомом углерода, находящимся в состоянии
- 21. Классификация спиртов I. По строению углеводородного радикала: - алифатические предельные и непредельные: пропанол-1, бутен-2-ол-1 - алициклические:
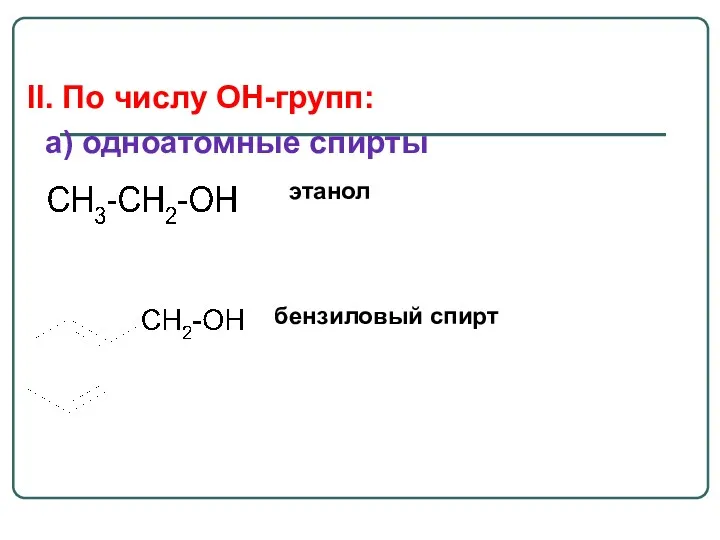
- 22. II. По числу OH-групп: a) одноатомные спирты этанол бензиловый спирт
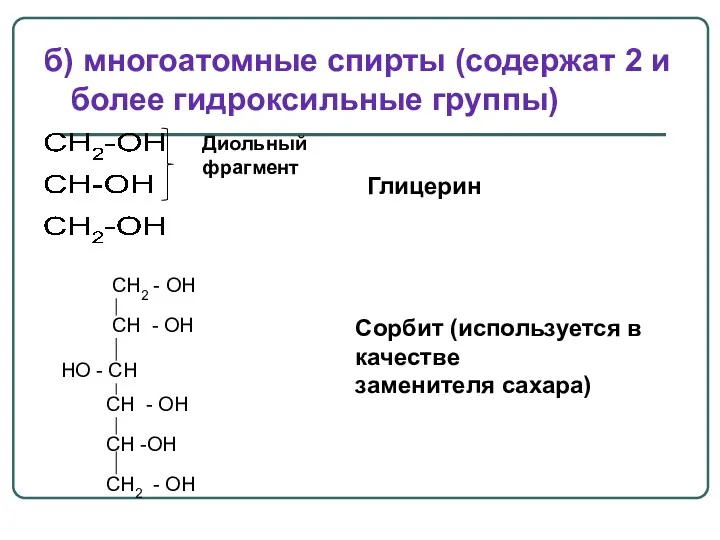
- 23. б) многоатомные спирты (содержат 2 и более гидроксильные группы) Глицерин Диольный фрагмент CH2 - OH CH
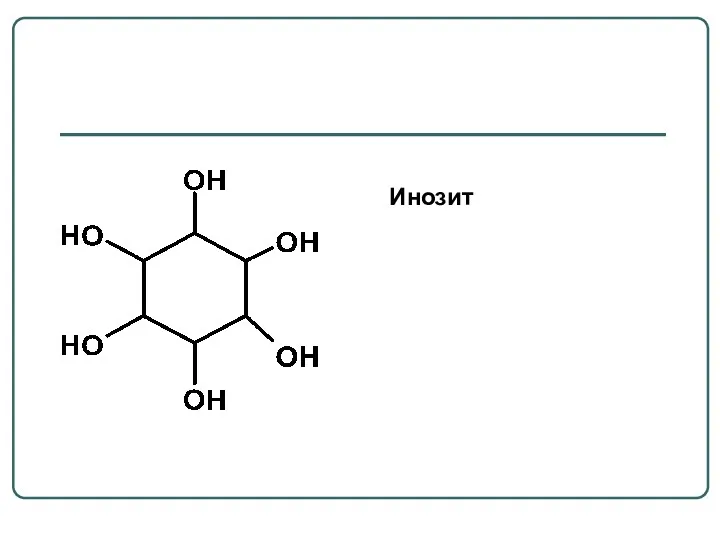
- 24. Инозит
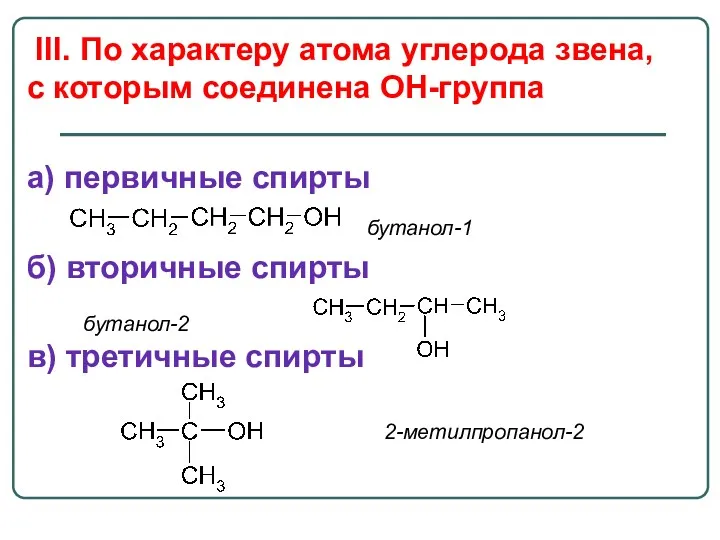
- 25. III. По характеру атома углерода звена, с которым соединена OH-группа a) первичные спирты б) вторичные спирты
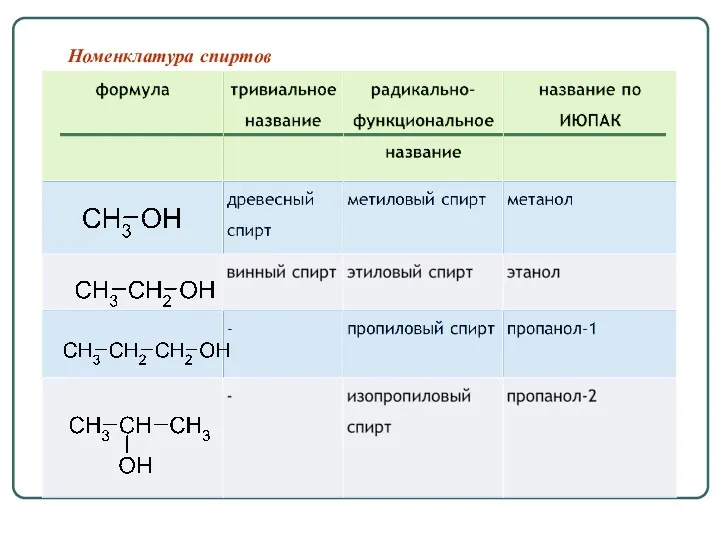
- 26. Номенклатура спиртов
- 27. 2. Одноатомные спирты: физические и химические свойства, способы получения.
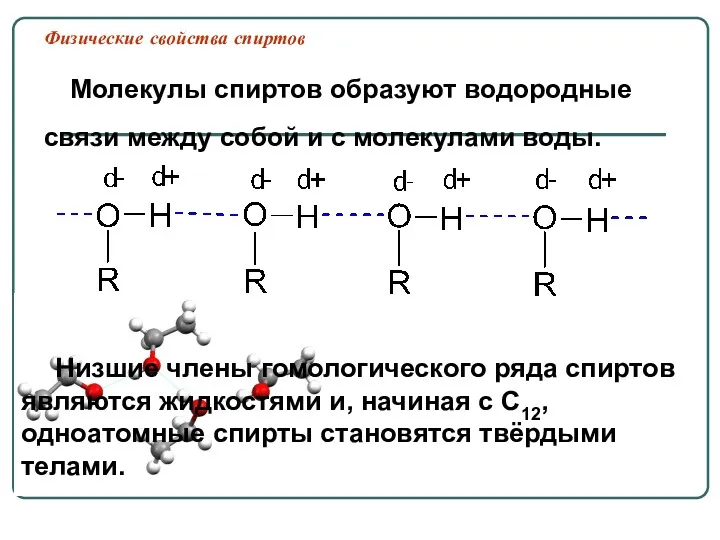
- 28. Физические свойства спиртов Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C12, одноатомные спирты
- 29. Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются
- 30. Метиловый спирт считается самым ядовитым спиртом. Прием внутрь вызывает слепоту или смерть. НЕ ПЕЙ МЕТИЛОВЫЙ СПИРТ
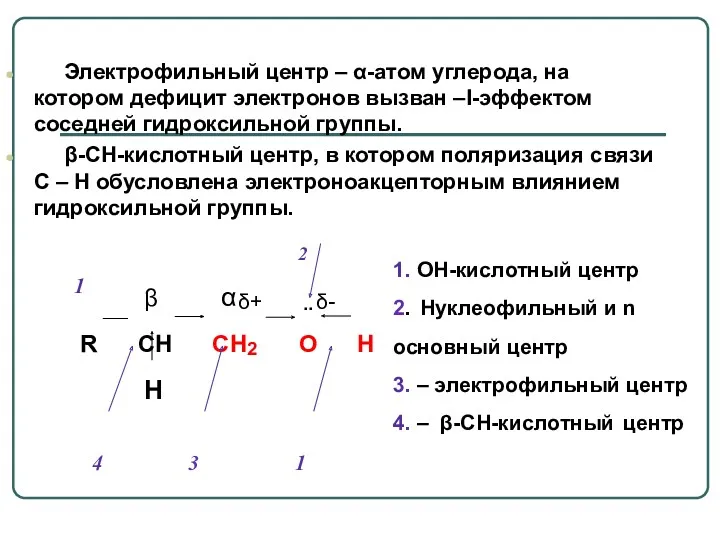
- 31. В молекуле спиртов можно выделить несколько реакционных центров: О-Н кислотный центр, за счет полярности связи способный
- 32. 1 R CH CH2 O H 4 3 1 1. OH-кислотный центр 2. Нуклеофильный и n
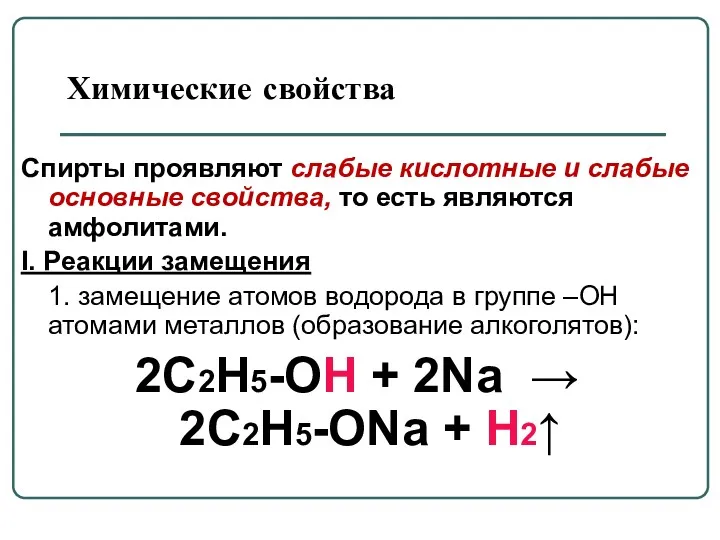
- 33. Химические свойства Спирты проявляют слабые кислотные и слабые основные свойства, то есть являются амфолитами. I. Реакции
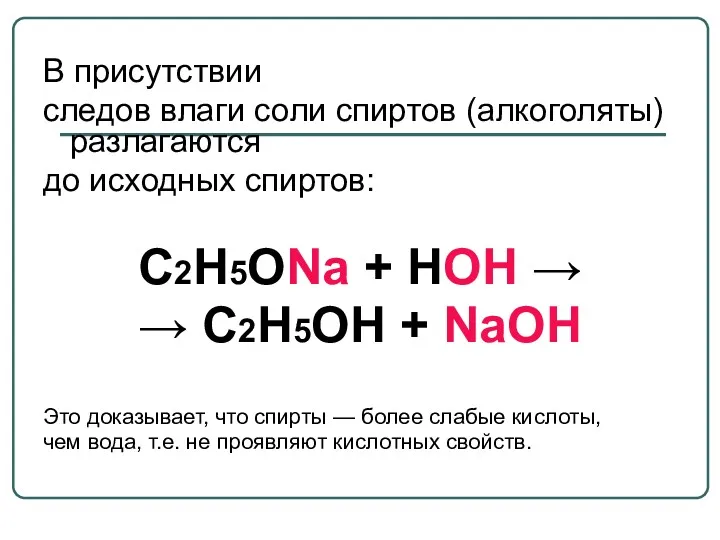
- 34. В присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов: С2Н5ОNa + НОН → →
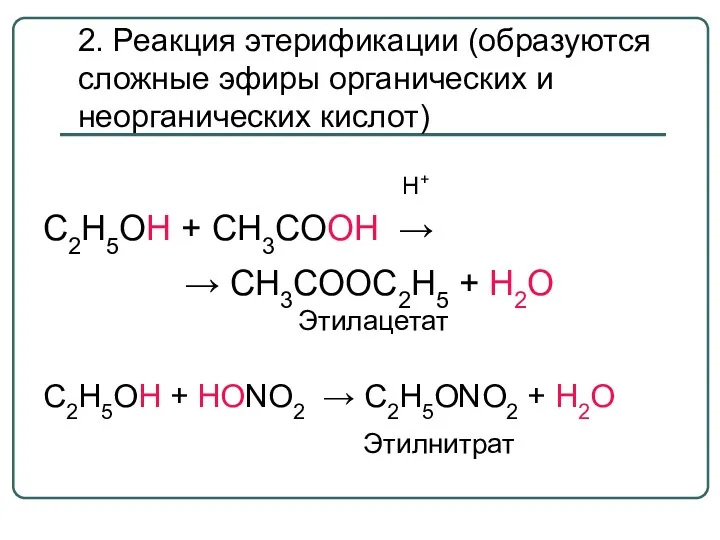
- 35. 2. Реакция этерификации (образуются сложные эфиры органических и неорганических кислот) Н+ С2Н5ОН + СН3СООН → →
- 36. 3. Замещение гидроксильной группы на галоген CH3-CH2-OH +НBr → C2H5-Br +H2O этанол бромэтан
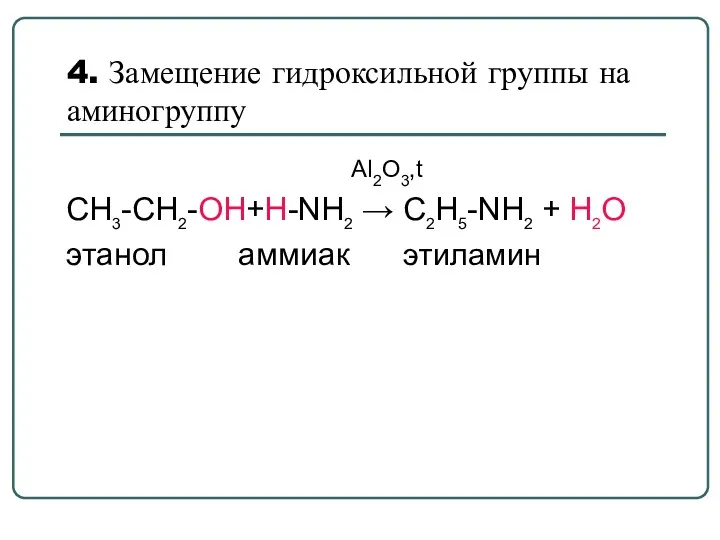
- 37. 4. Замещение гидроксильной группы на аминогруппу Al2O3,t CH3-CH2-OH+Н-NН2 → C2H5-NН2 + H2O этанол аммиак этиламин
- 38. II. Реакции отщепления (элиминирования) Виды реакций отщепления: - межмолекулярная дегидратация - внутримолекулярная дегидратация - дегидрирование
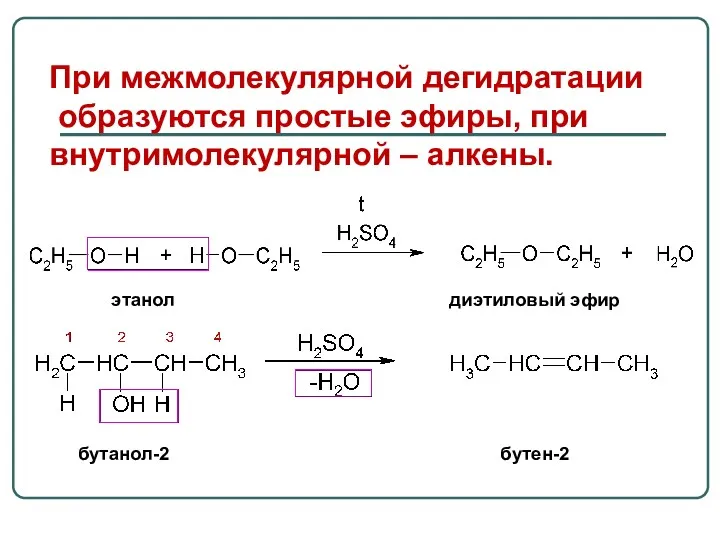
- 39. При межмолекулярной дегидратации образуются простые эфиры, при внутримолекулярной – алкены. бутанол-2 бутен-2 этанол диэтиловый эфир
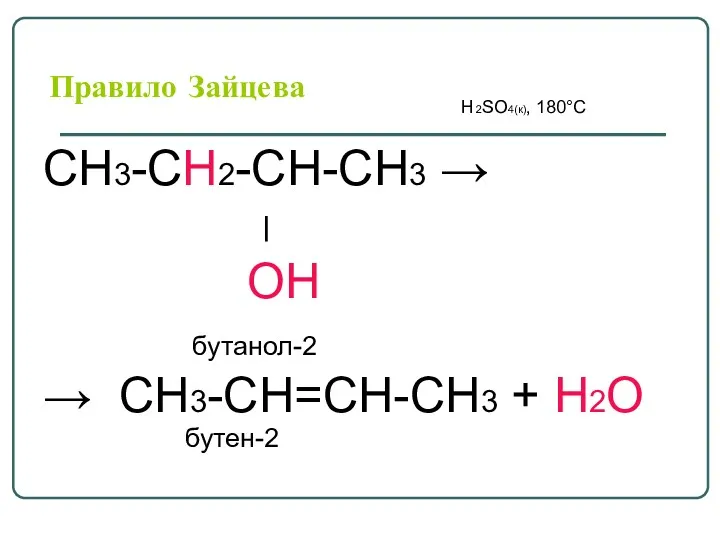
- 40. Правило Зайцева H2SO4(к), 180°С СН3-СН2-СН-СН3 → ׀ ОН бутанол-2 → СН3-СН=СН-СН3 + Н2О бутен-2
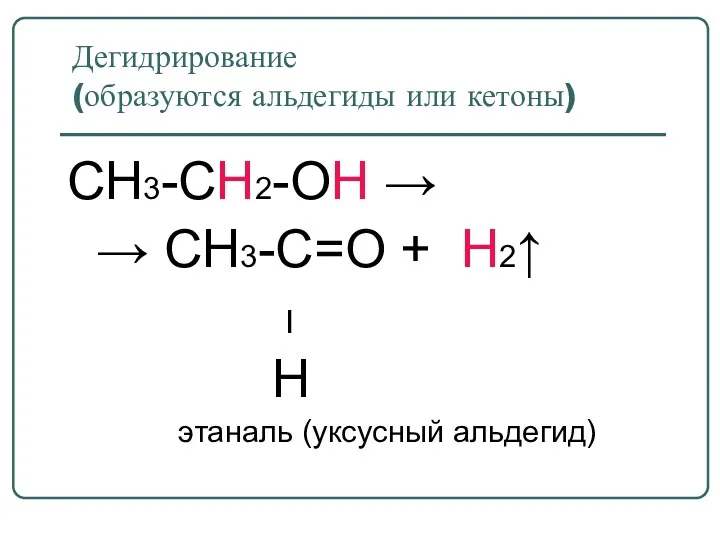
- 41. Дегидрирование (образуются альдегиды или кетоны) CH3-CH2-OH → → CH3-C=O + H2↑ ׀ H этаналь (уксусный альдегид)
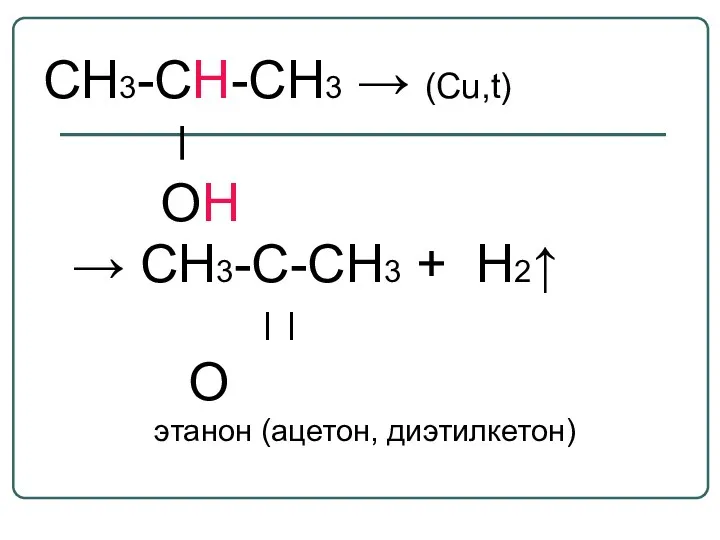
- 42. СН3-СН-СН3 → (Cu,t) ׀ ОН → CH3-C-СH3 + H2↑ ׀ ׀ O этанон (ацетон, диэтилкетон)
- 43. III. Реакции окисления Горение C2H5-OH +3О2→ → 2CO2 + 3H2O+ Q
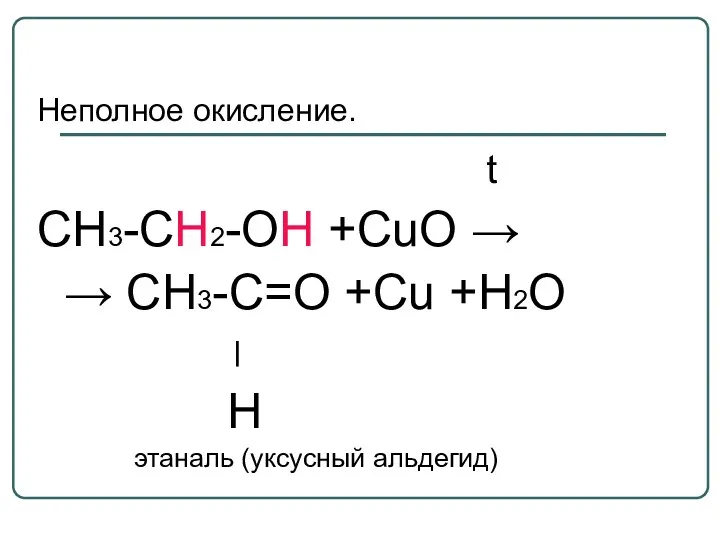
- 44. Неполное окисление. t CH3-CH2-OH +CuO → → CH3-C=O +Cu +H2О ׀ H этаналь (уксусный альдегид)
- 45. Способы получения спиртов Гидратация алкенов Щелочной гидролиз галогеноалканов (в присутствии водного раствора щелочи) Гидрирование альдегидов и
- 46. Специфические способы получения метанола и этанола 1. Синтез метанола из водяного газа (катализатор, давление, температура): СО+
- 47. 3. Многоатомные спирты
- 48. Многоатомные спирты Присутствие в молекулах многоатомных спиртов двух и более гидроксильных групп обуславливает некоторые отличия в
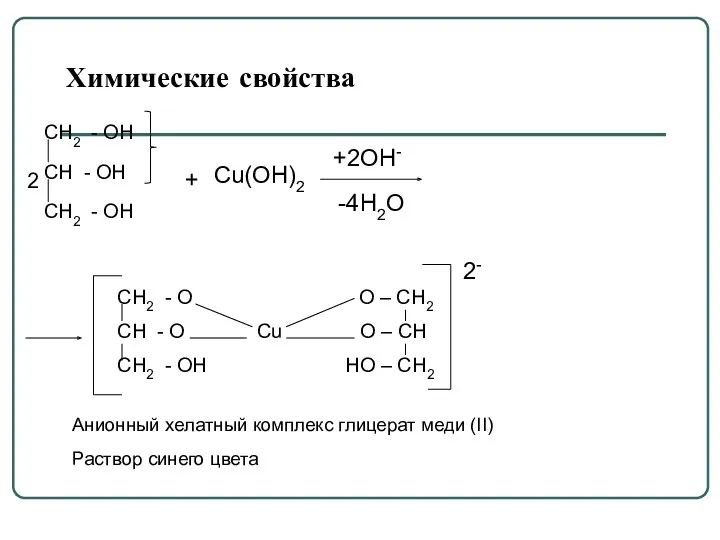
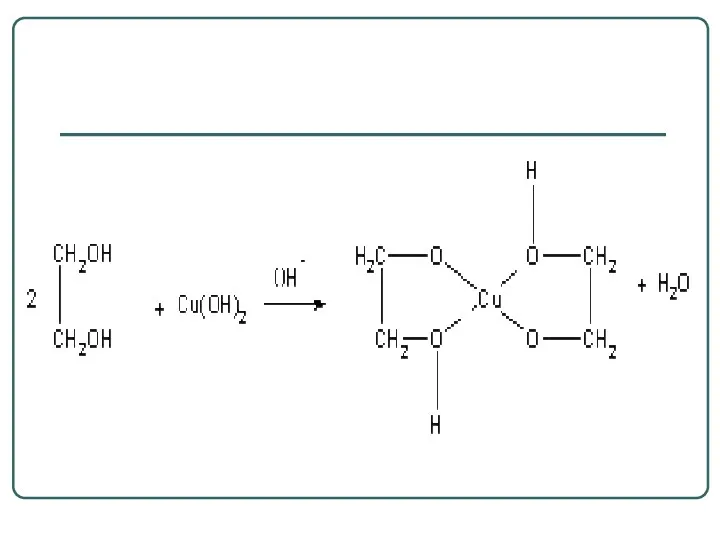
- 49. Химические свойства CH2 - OH CH - OH CH2 - OH Cu(ОН)2 +2ОН- -4Н2О CH2 -
- 51. Данная реакция используется для качественного обнаружения многоатомных спиртов. В реакцию при этом вступает α-диольный фрагмент.
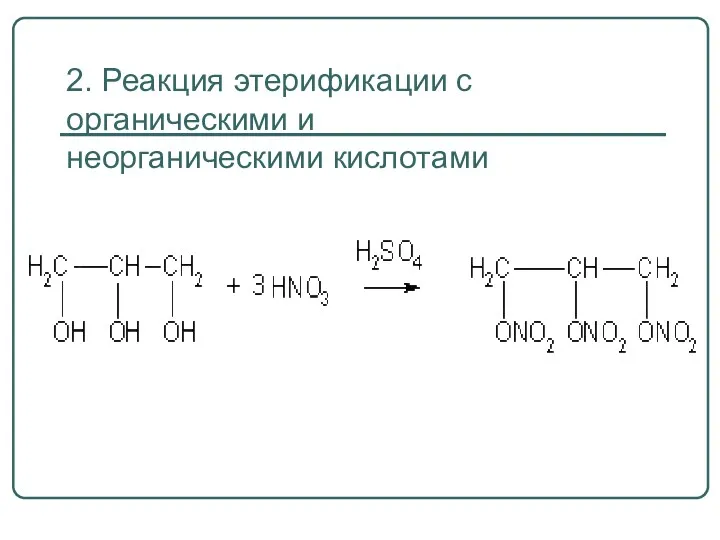
- 52. 2. Реакция этерификации с органическими и неорганическими кислотами
- 53. Способы получения Получение гликолей 1. Окисление алкенов перманганатом калия в нейтральной среде (гидроксилирование) Щелочной гидролиз дигалогеналканов
- 54. Физические свойства Этиленгликоль и глицерин при обычных условиях представляют собой бесцветные вязкие жидкости, легко смешивающиеся с
- 55. 4. Фенолы: характеристика, способы получения, свойства, применение
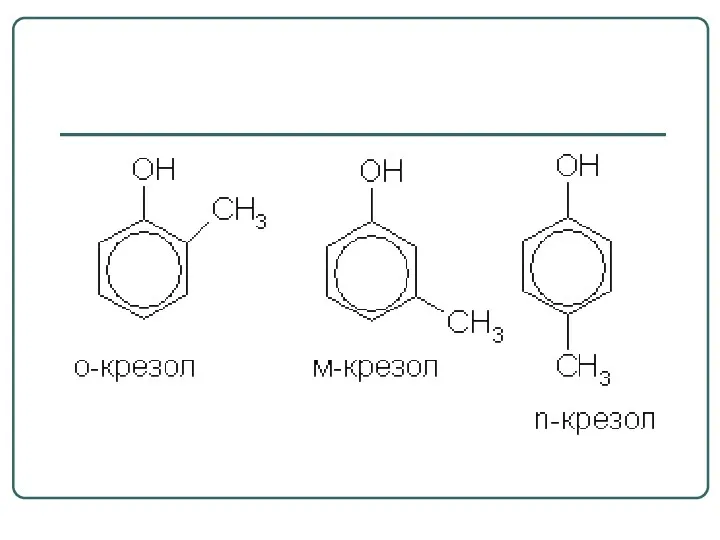
- 56. Фенолы По количеству OH-групп различают: фенол a) Одноатомные фенолы Фенолы – гидроксисоединения, в молекулах которых OH-группы
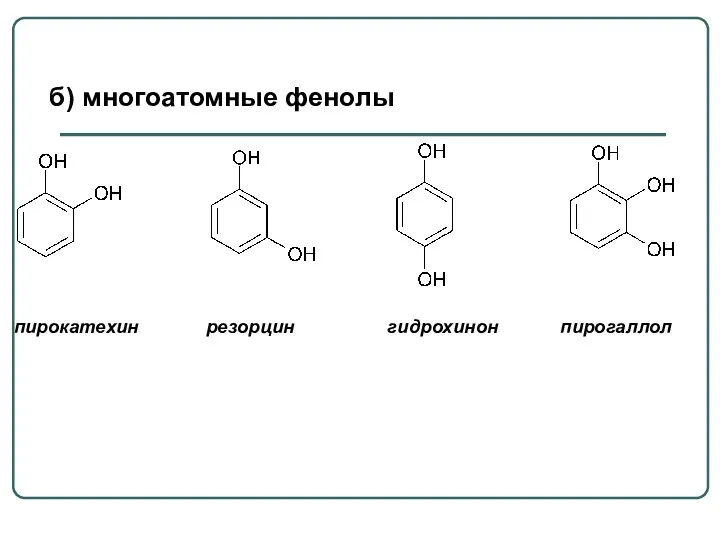
- 58. пирокатехин резорцин гидрохинон пирогаллол б) многоатомные фенолы
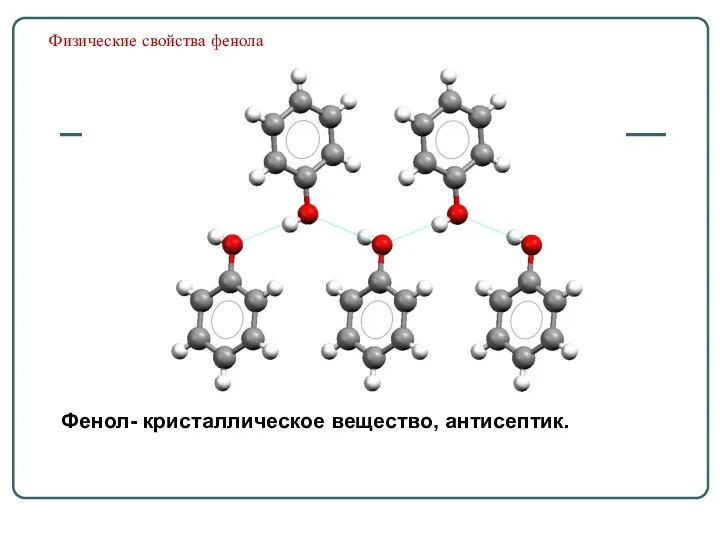
- 59. Физические свойства фенола Фенол- кристаллическое вещество, антисептик.
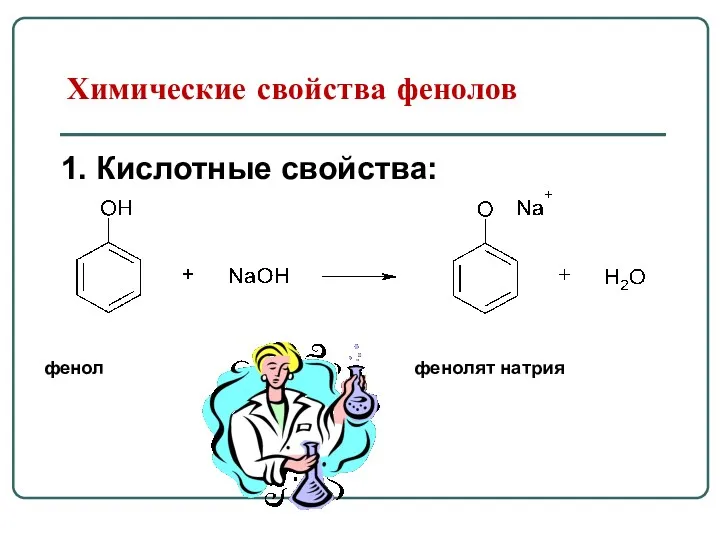
- 60. Химические свойства фенолов 1. Кислотные свойства: фенол фенолят натрия
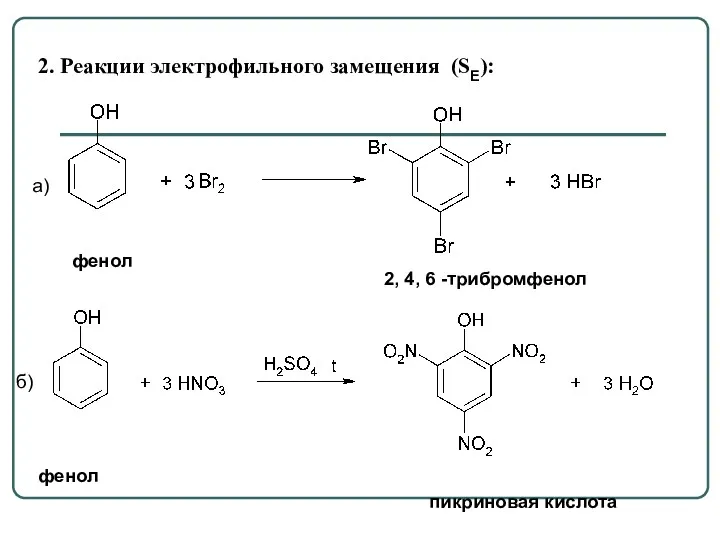
- 61. 2. Реакции электрофильного замещения (SE): а) б) фенол пикриновая кислота фенол 2, 4, 6 -трибромфенол
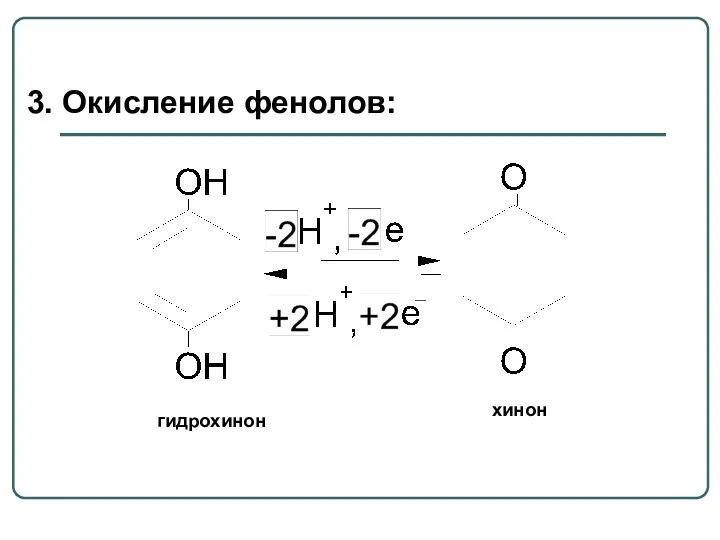
- 62. 3. Окисление фенолов: гидрохинон хинон
- 63. 4. Реакции присоединения (гидрирование) с образованием алициклических спиртов (циклогексанол) 5. Качественная реакция с хлоридом железа (III):
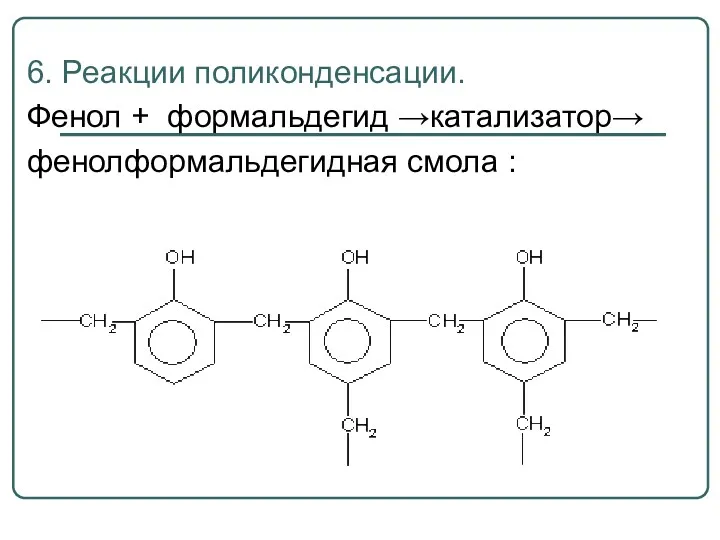
- 64. 6. Реакции поликонденсации. Фенол + формальдегид →катализатор→ фенолформальдегидная смола :
- 66. Скачать презентацию




























 Классный час к празднику 23 февраля Путешествие в разные страны за днём мужчин
Классный час к празднику 23 февраля Путешествие в разные страны за днём мужчин Органическая химия.Белки.Жиры.Углеводы.
Органическая химия.Белки.Жиры.Углеводы. Комплексно-тематическое планирование Книжкина неделя
Комплексно-тематическое планирование Книжкина неделя Оформление древнерусских книг
Оформление древнерусских книг Видільна система. 8 клас
Видільна система. 8 клас Основы обороны государства. Лекция 5
Основы обороны государства. Лекция 5 Презентация Стихи Агнии Барто
Презентация Стихи Агнии Барто Ленин Владимир Ильич - человек, “перевернувший Россию”
Ленин Владимир Ильич - человек, “перевернувший Россию” Выдающаяся личность Джаред Падалеки
Выдающаяся личность Джаред Падалеки презентация Лекарственные растения
презентация Лекарственные растения Половое воспитание
Половое воспитание Энергосбережение в строительстве. Япония
Энергосбережение в строительстве. Япония Расчет одиночных трубчатых колодцев (скважин)
Расчет одиночных трубчатых колодцев (скважин) Тұздар химиялық қосылыстар класы
Тұздар химиялық қосылыстар класы Смертная казнь. Отношение общества к данной мере наказания
Смертная казнь. Отношение общества к данной мере наказания Игра Подари картинки Боре
Игра Подари картинки Боре Программа ИГРАЛОЧКА. Игра как средство развития логического мышления
Программа ИГРАЛОЧКА. Игра как средство развития логического мышления Лес - наше богатство. Викторина
Лес - наше богатство. Викторина Геморрагический васкулит у детей
Геморрагический васкулит у детей Экосистемы. Понятие экосистемы
Экосистемы. Понятие экосистемы Виброакустический метод диагностирования технического состояния колесно-моторного блока
Виброакустический метод диагностирования технического состояния колесно-моторного блока Социальная политика ТРАНСАЭРО
Социальная политика ТРАНСАЭРО Зороастризм
Зороастризм Проект Театр своими руками
Проект Театр своими руками Алгоритмы решения задач по химии (I часть)
Алгоритмы решения задач по химии (I часть) Всероссийская акция Привет солдату
Всероссийская акция Привет солдату Триггеры и их классификация
Триггеры и их классификация Портфолио профессиональной деятельности воспитателя Николенко Татьяны Николаевны
Портфолио профессиональной деятельности воспитателя Николенко Татьяны Николаевны