Содержание
- 3. Ферменты – это белки, способные быть катализаторами биохимических реакций
- 4. Биологические особенности ферментного катализа Нейтральный рН Водная среда Температура 40оС Нормальное атмосферное давление Высокая скорость реакций
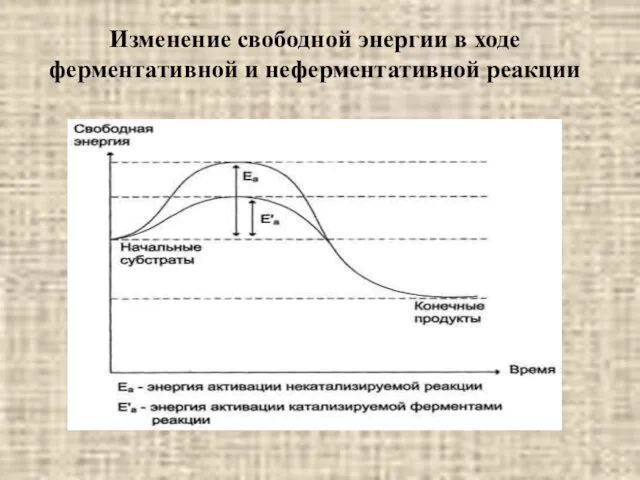
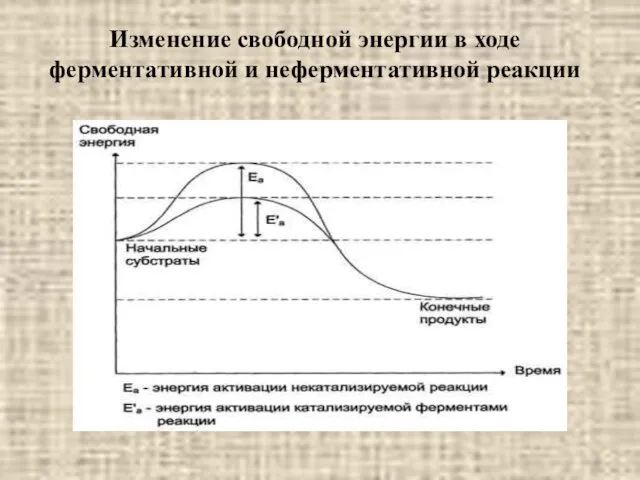
- 5. Изменение свободной энергии в ходе ферментативной и неферментативной реакции
- 6. Энергия активации – это такое количество энергии в калориях, которое необходимо для того, чтобы все молекулы
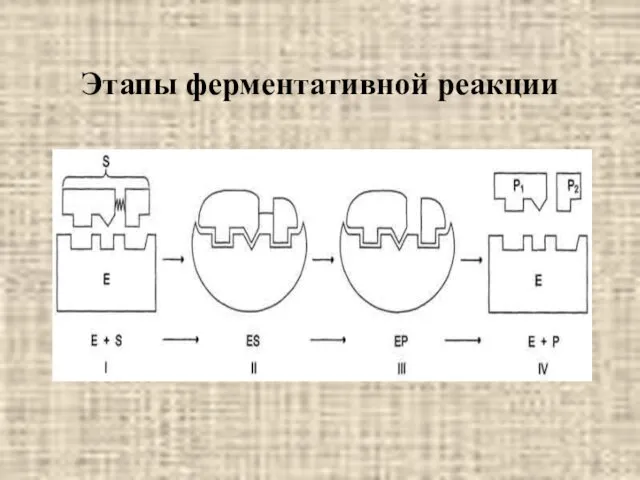
- 7. Этапы ферментативной реакции
- 8. Преимущества реакции с участием фермента Сближение и ориентация субстрата в активном центре фермента Исключение воды из
- 9. Изменение свободной энергии в ходе ферментативной и неферментативной реакции
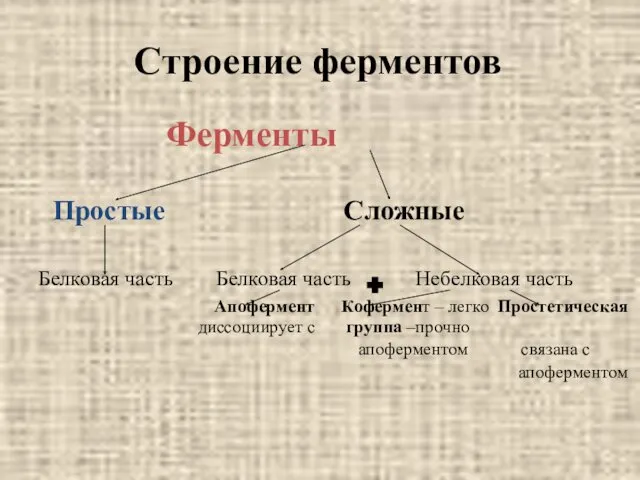
- 10. Строение ферментов Ферменты Простые Сложные Белковая часть Белковая часть Небелковая часть Апофермент Кофермент – легко Простетическая
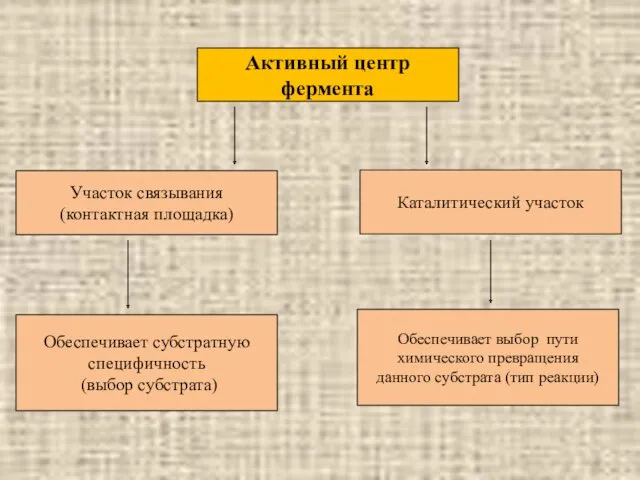
- 11. Активный центр фермента Участок связывания (контактная площадка) Каталитический участок Обеспечивает субстратную специфичность (выбор субстрата) Обеспечивает выбор
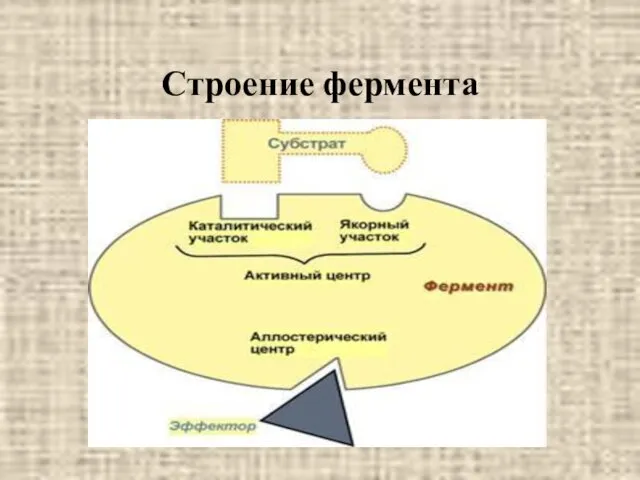
- 12. Строение фермента
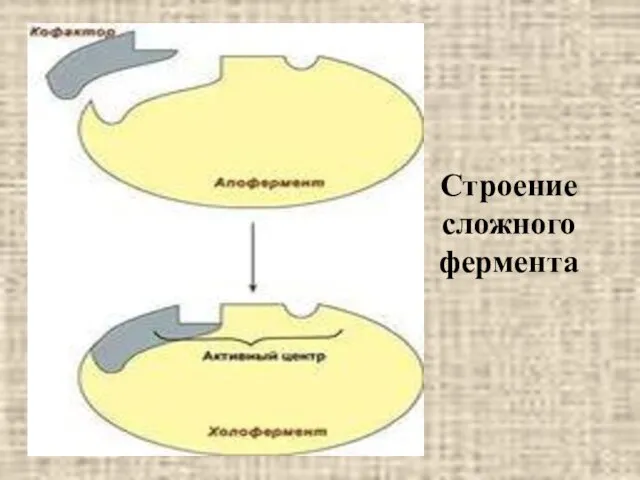
- 13. Строение сложного фермента
- 14. Специфичность – это высокая избирательность действия ферментов, основанная на комплементарности структуры субстрата и активного центра фермента.
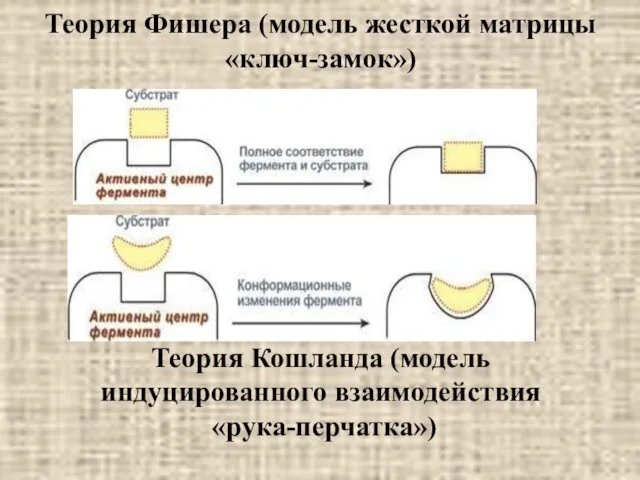
- 15. Теория Фишера (модель жесткой матрицы «ключ-замок») Теория Кошланда (модель индуцированного взаимодействия «рука-перчатка»)
- 16. Виды специфичности ферментов Абсолютная Стереохимическая Относительная (групповая)
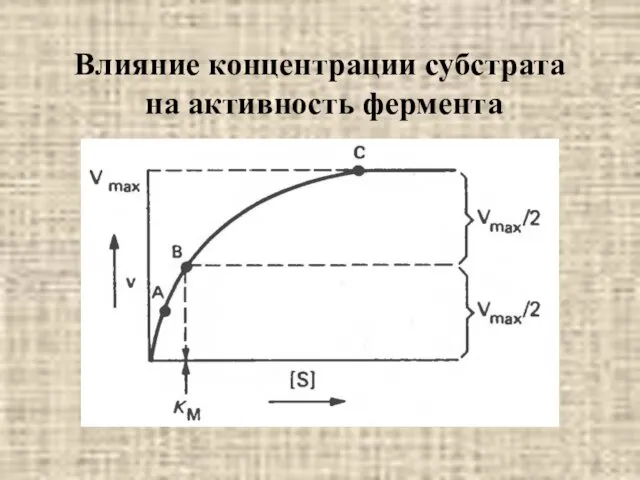
- 17. Активность фермента – это изменение субстрата под влиянием фермента в единицу времени.
- 18. Единицы активности ферментов Ф + С ФСК Ф + П 1 катал = 1 моль/с =
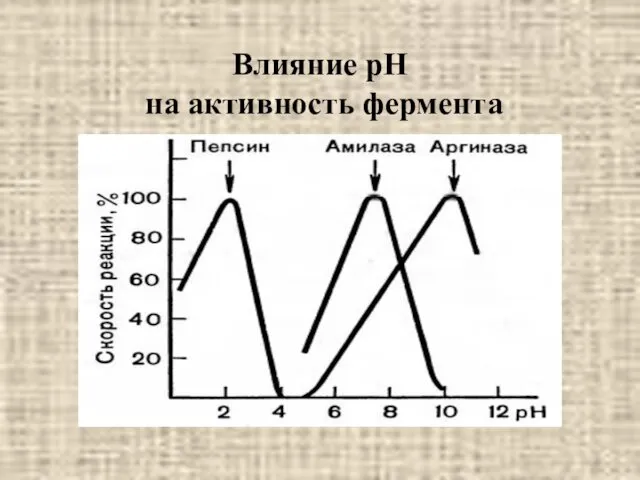
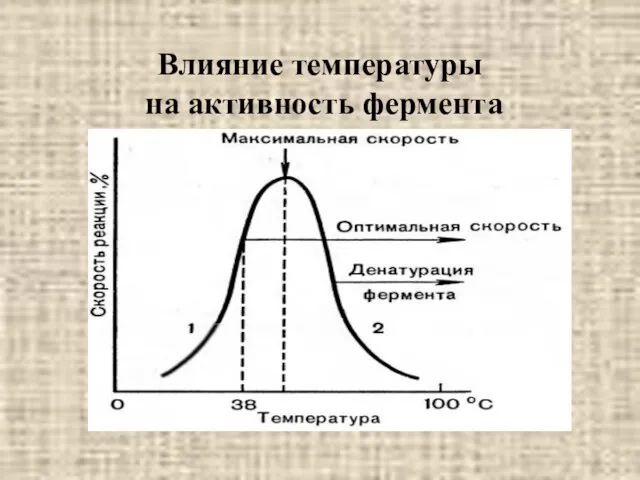
- 19. Способы регулирования активности ферментов путем изменения: Концентрации субстрата рН среды Температуры Химического состава реакционной среды
- 20. Влияние концентрации субстрата на активность фермента
- 21. Влияние рН на активность фермента
- 22. Влияние температуры на активность фермента
- 23. Влияние химического состава реакционной среды на активность ферментов Активация Ингибирование
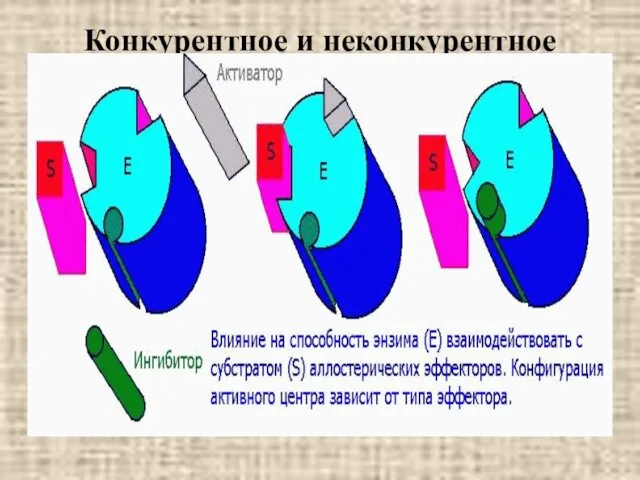
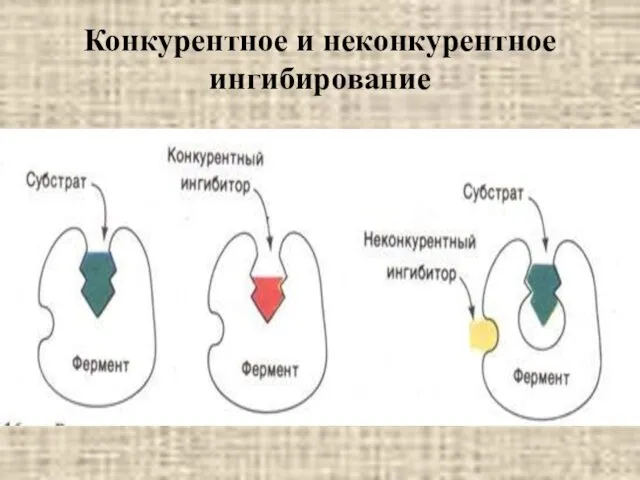
- 24. Конкурентное и неконкурентное ингибирование
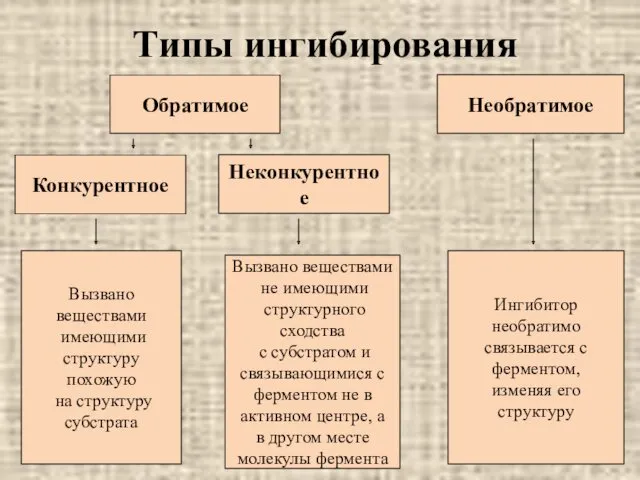
- 25. Типы ингибирования Обратимое Необратимое Конкурентное Неконкурентное Вызвано веществами имеющими структуру похожую на структуру субстрата Вызвано веществами
- 26. Конкурентное и неконкурентное ингибирование
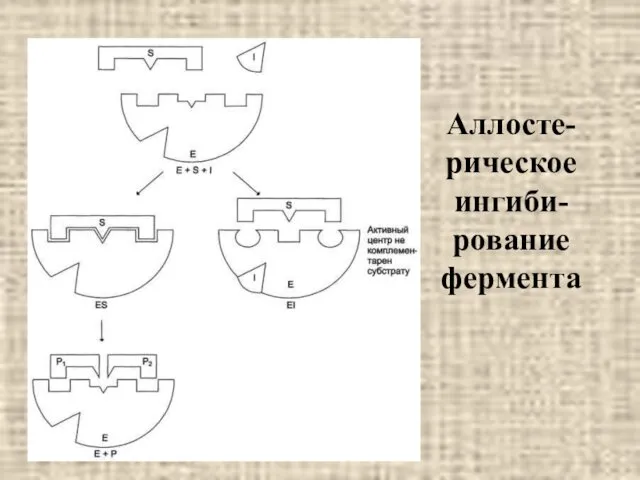
- 27. Аллосте-рическое ингиби-рование фермента
- 28. Особенности аллостерических ферментов это олигомерные белки имеют аллостерический центр проявляют различную специфичность к аллостерическим модуляторам регуляция
- 29. Виды ковалентной модификации каталитической активности ферментов Частичный протеолиз Ассоциация – диссоциация Фосфорилирование - дефосфорилирование
- 30. Регуляция активности фермента путем частичного протеолиза Профермент активная форма фермента + пептид
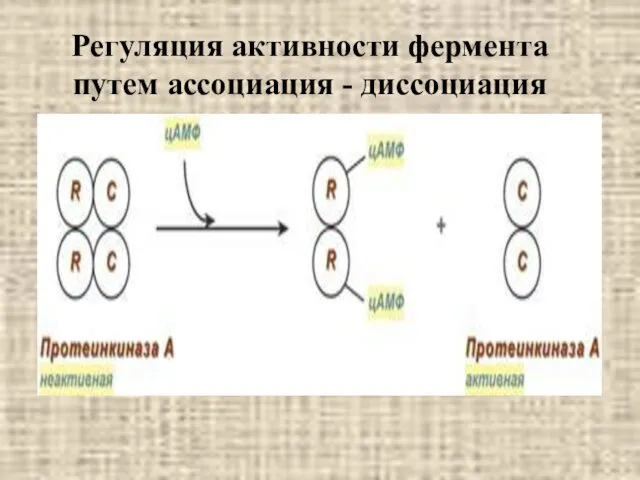
- 31. Регуляция активности фермента путем ассоциация - диссоциация
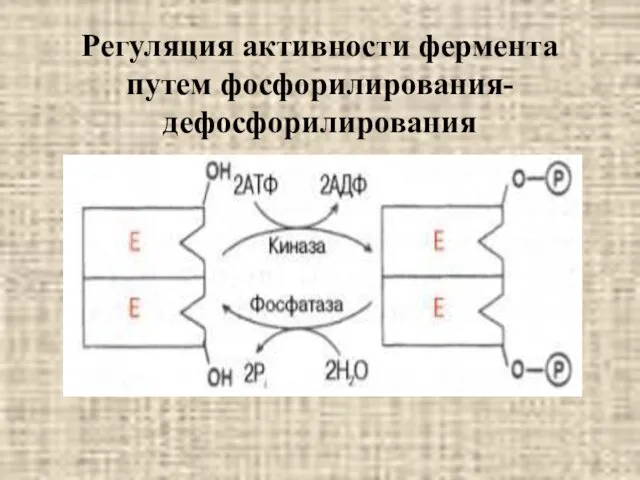
- 32. Регуляция активности фермента путем фосфорилирования- дефосфорилирования
- 33. Изоферменты – это ферменты, катализирующие одинаковые реакции, но отличающиеся физико-химическими и биохимическими параметрами.
- 34. Изоферментные формы лактатдегидрогеназы (ЛДГ) АААА ЛДГ 1 сердце АААВ ЛДГ 2 ААВВ ЛДГ 3 АВВВ ЛДГ
- 35. Факторы, определяющие распространение изоферментов Особенности метаболизма в различных органах и тканях Особенности метаболизма в различных органеллах
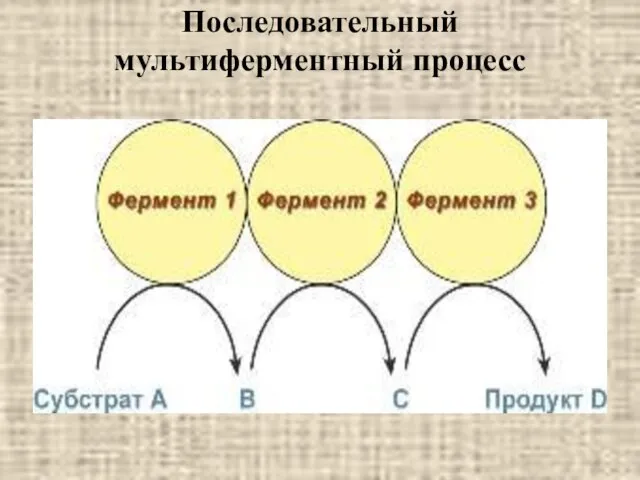
- 36. Последовательный мультиферментный процесс
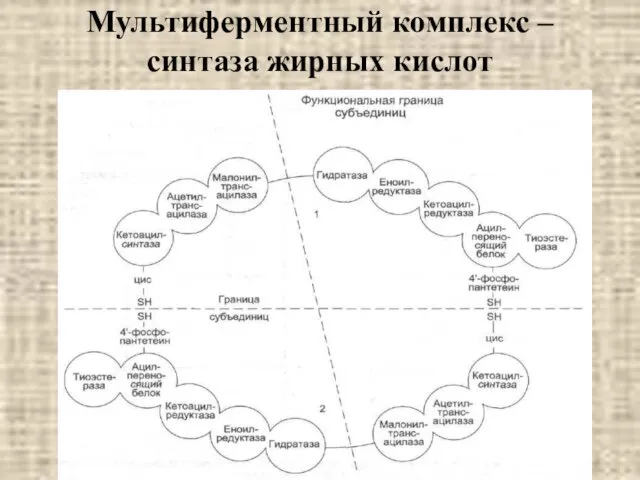
- 37. Мультиферментный комплекс – синтаза жирных кислот
- 39. Скачать презентацию

















 Сложноподчиненные предложения
Сложноподчиненные предложения Методы и методические приемы обучения биологии
Методы и методические приемы обучения биологии Электродвигатели постоянного тока. Первый этап развития электродвигателя
Электродвигатели постоянного тока. Первый этап развития электродвигателя Булану мен конденсация
Булану мен конденсация Дерево тематик. Пассажиры
Дерево тематик. Пассажиры Этапы развития механизации ПРТС-работ. Организация погрузочно-разгрузочных, транспортных и складских работ
Этапы развития механизации ПРТС-работ. Организация погрузочно-разгрузочных, транспортных и складских работ Векторная графика в Web
Векторная графика в Web Презентация Коллекционирование как исследовательская практика ребёнка(Из опыта работы по программе А.И. Савенкова)
Презентация Коллекционирование как исследовательская практика ребёнка(Из опыта работы по программе А.И. Савенкова) деление десятичной дроби на натуральное число
деление десятичной дроби на натуральное число Типы климатов России разработка урока географии 8 класс
Типы климатов России разработка урока географии 8 класс Всероссийская олимпиада по искусству. Школьный этап. (9-11 класс)
Всероссийская олимпиада по искусству. Школьный этап. (9-11 класс) Рабочий отчет департамента аналитики компании IPO
Рабочий отчет департамента аналитики компании IPO There is, are
There is, are Презентация Виды современных велосипедов Диск
Презентация Виды современных велосипедов Диск Статистика посещения кинотеатров в России, 2009-2019 годы
Статистика посещения кинотеатров в России, 2009-2019 годы презентация результата совместного проекта с родителями
презентация результата совместного проекта с родителями Тест. Планеты Солнечной системы
Тест. Планеты Солнечной системы Презентации по основам православной культуры
Презентации по основам православной культуры Кодекс этической деятельности педагога
Кодекс этической деятельности педагога Развитие зрительного восприятия у детей с ОНР через игровую систему обучения
Развитие зрительного восприятия у детей с ОНР через игровую систему обучения Кітап оқуға баулу
Кітап оқуға баулу Летний профильный отряд по химии Волшебный мир химии
Летний профильный отряд по химии Волшебный мир химии Древняя Индия
Древняя Индия Ұлпа қабынуын емдеудің салыстырмалы сипаттамасы
Ұлпа қабынуын емдеудің салыстырмалы сипаттамасы Требования к хорошему кейсу
Требования к хорошему кейсу Как семейные традиции укрепляют семью
Как семейные традиции укрепляют семью Послеродовые гнойно-септические заболевания (перитонит, сепсис, токсико-инфекционный шок)
Послеродовые гнойно-септические заболевания (перитонит, сепсис, токсико-инфекционный шок) 7 класс: Население и страны Северной Америки
7 класс: Население и страны Северной Америки