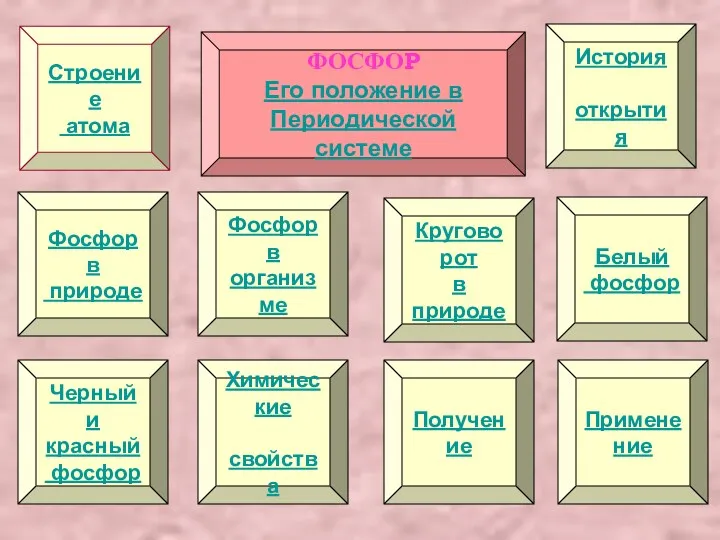
Содержание
- 2. Строение атома Химические свойства Круговорот в природе Получение Фосфор в природе Фосфор в организме Белый фосфор
- 3. «Фосфор…- элемент жизни и мысли.» академик А.Е. Ферсман. P
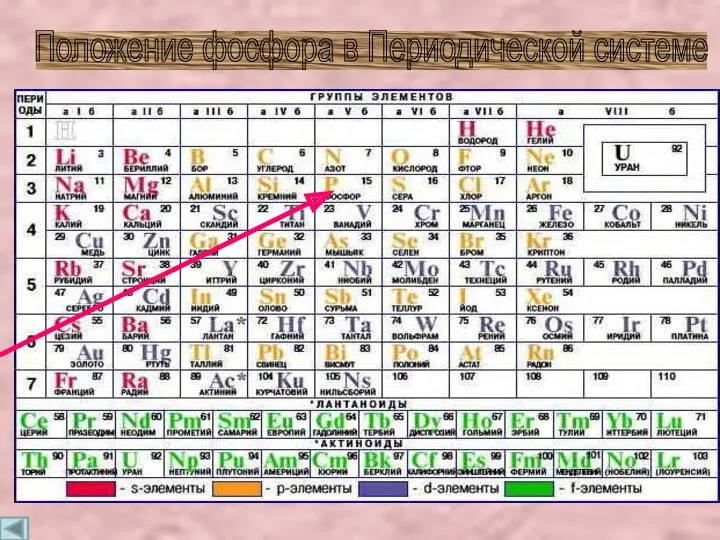
- 4. Положение фосфора в Периодической системе
- 5. В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте
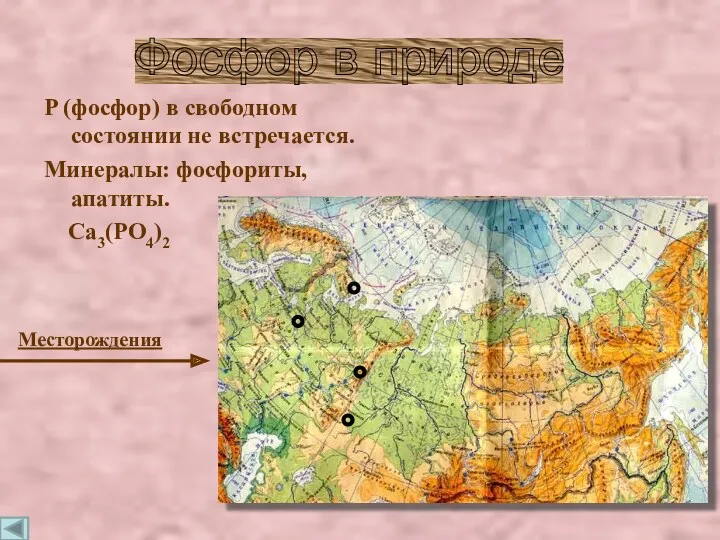
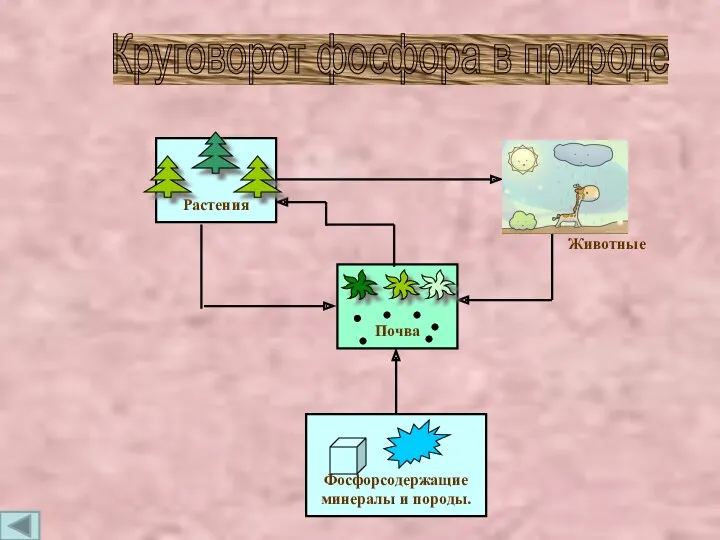
- 6. P (фосфор) в свободном состоянии не встречается. Минералы: фосфориты, апатиты. Ca3(PO4)2 Месторождения Фосфор в природе
- 7. Р заряд ядра= +15 31P Электронная конфигурация: Р Р* (стационарное) (возбужденное) 1s2 2s2 2p6 3s1 3p3
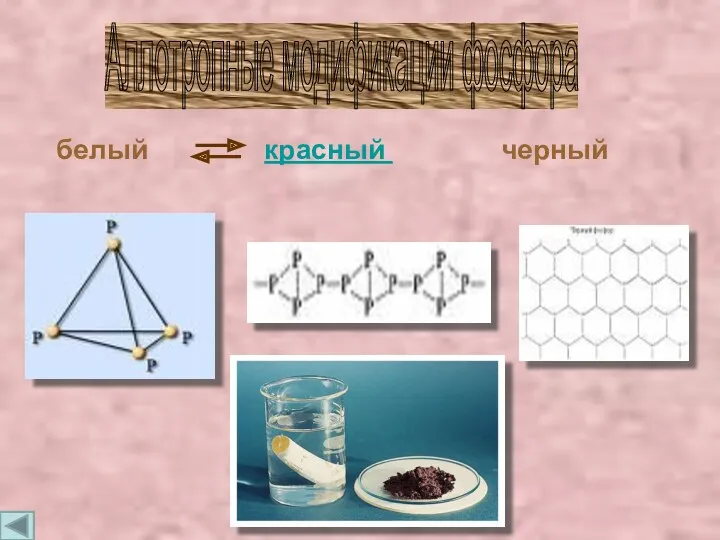
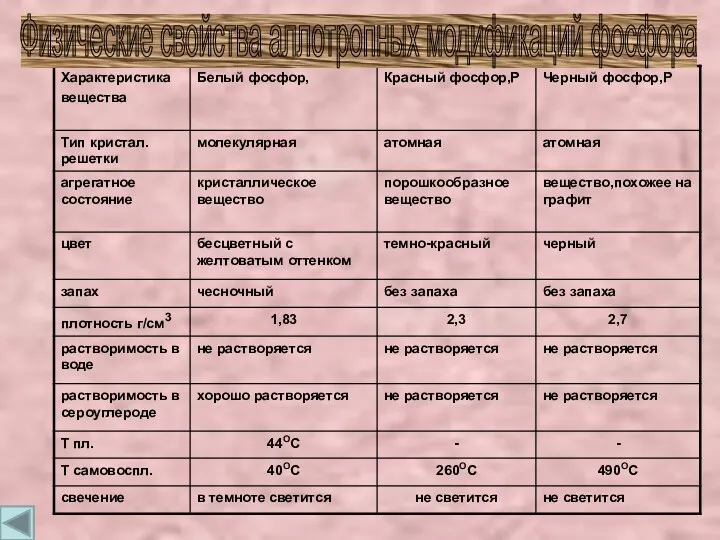
- 8. белый красный черный Аллотропные модификации фосфора
- 9. Состоит из молекул P4. Белое мягкое кристаллическое вещество. Чесночный запах. t плавления 44 oC, самовоспламеняющийся порошок.
- 10. Черный фосфор: Похож на графит. Проводит электрический ток. t плавления 597 оС. Атомная кристаллическая решетка. Нерастворим
- 11. Физические свойства аллотропных модификаций фосфора
- 12. Фосфорсодержащие минералы и породы. Почва Растения Животные Круговорот фосфора в природе
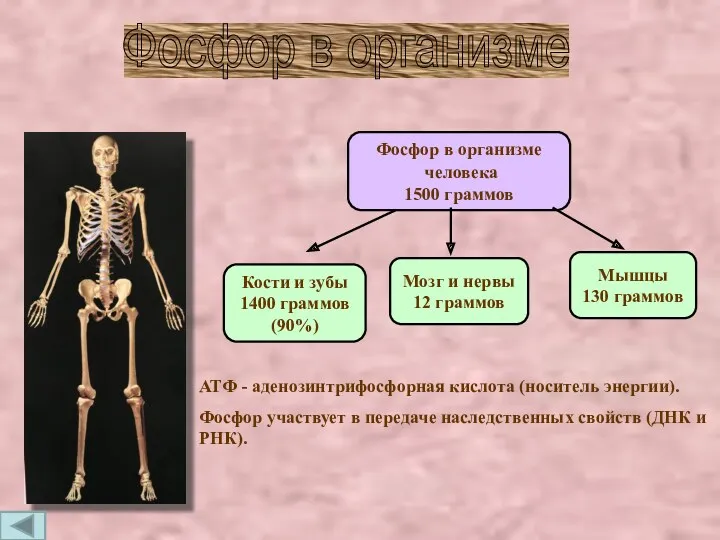
- 13. Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мышцы 130 граммов Мозг
- 14. Из апатитов и фосфоритов в электрической печи: Са3(РО4)2+5С+3SiO2 3CaSiO3+2P+5CO P+5 +5e P 2 C0 -2e C+2
- 15. Химические свойства фосфора Р0 Р-3 Р+5 окислитель восстановитель I. Фосфор – окислитель: При реакции с активными
- 16. При взаимодействии со щелочами образуется фосфин PH3: 2Р + 2NaOH + H2O = Na2HPO3 + PH3
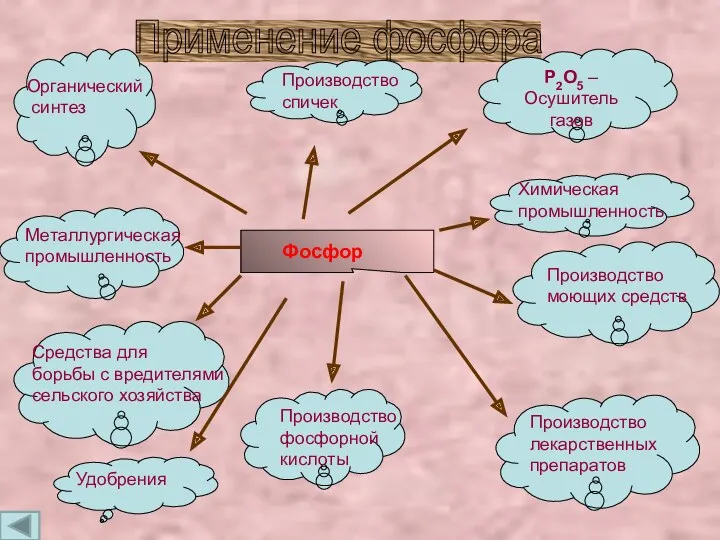
- 17. Применение фосфора Фосфор Производство спичек Р2О5 – Осушитель газов Органический синтез Химическая промышленность Металлургическая промышленность Средства
- 19. Скачать презентацию








 Психоаналитическая концепция личности
Психоаналитическая концепция личности Презентация к занятию по риторике № 14 Слушаем и стараемся понять ... (2 класс)
Презентация к занятию по риторике № 14 Слушаем и стараемся понять ... (2 класс) конспект занятия по социально -коммуникативному развитию по теме Служба 01 всегда на страже Конспект занятия НОД по области Социально – коммуникативное развитие в старшей группе № 15 Знайки&raqu
конспект занятия по социально -коммуникативному развитию по теме Служба 01 всегда на страже Конспект занятия НОД по области Социально – коммуникативное развитие в старшей группе № 15 Знайки&raqu проект Учимся быть здоровыми
проект Учимся быть здоровыми Как встречают Новый год люди всех земных широт
Как встречают Новый год люди всех земных широт Родительское собрание на тему Домашние задания
Родительское собрание на тему Домашние задания Расчет и проектирование двутавровой балки для заданных условий работы
Расчет и проектирование двутавровой балки для заданных условий работы Краеведение
Краеведение Общение педагога с родителями воспитанников
Общение педагога с родителями воспитанников Отчет совета молодежи
Отчет совета молодежи Хранящие память
Хранящие память Робот STR-17 на платформе Аrduino
Робот STR-17 на платформе Аrduino Метод проектов на занятиях в творческой мастерской Рукодельница
Метод проектов на занятиях в творческой мастерской Рукодельница Мой город. Мой дом. Моя улица. Дидактические игры для дошкольников
Мой город. Мой дом. Моя улица. Дидактические игры для дошкольников Экономическая теория, как наука. (Тема 1)
Экономическая теория, как наука. (Тема 1) Презентация для уроков ОБЖ в 1-4 классах на туму Советы пешеходам Диск
Презентация для уроков ОБЖ в 1-4 классах на туму Советы пешеходам Диск Технологическая карта урока
Технологическая карта урока Божья коровка
Божья коровка edvard_grig
edvard_grig Основы волонтёрского движения
Основы волонтёрского движения Мир вокруг нас
Мир вокруг нас проектно-исследовательская работаЖестяная банка
проектно-исследовательская работаЖестяная банка Оценка на уроке
Оценка на уроке Основные типы установок высокой эффективности
Основные типы установок высокой эффективности Фотограмметрия. Геометрические и физические основы фотограмметрии. (Лекция 2)
Фотограмметрия. Геометрические и физические основы фотограмметрии. (Лекция 2) Анализ финансовой устойчивости предприятия
Анализ финансовой устойчивости предприятия Русская православная церковь
Русская православная церковь Историческое сочинение
Историческое сочинение