Фосфор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение презентация
Содержание
- 2. Фосфор 1s2 2s2 2p6 3s2 3p3 Сродство к электрону 0.6 эВ Атомный радиус 13.4 Å Степени
- 3. Апатит Ca5(PO4) (F,Cl) Фосфорит Ca5(PO4) (ОН,CО3) Месторождение фосфора В земной коре: 0,08% В человеческом организме: 1,16%
- 4. История открытия XII век Алхид Бехир “драгоценный карбункул” 1669 год Хённиг Бранд 1680 Роберт Бойль 1769
- 5. Получение Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре
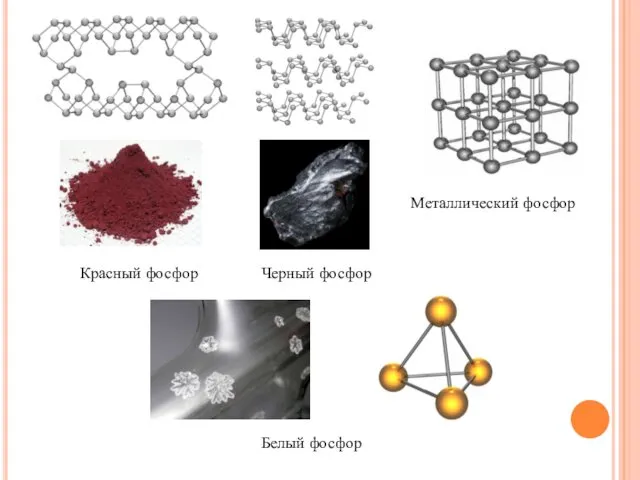
- 6. Красный фосфор Черный фосфор Белый фосфор Металлический фосфор
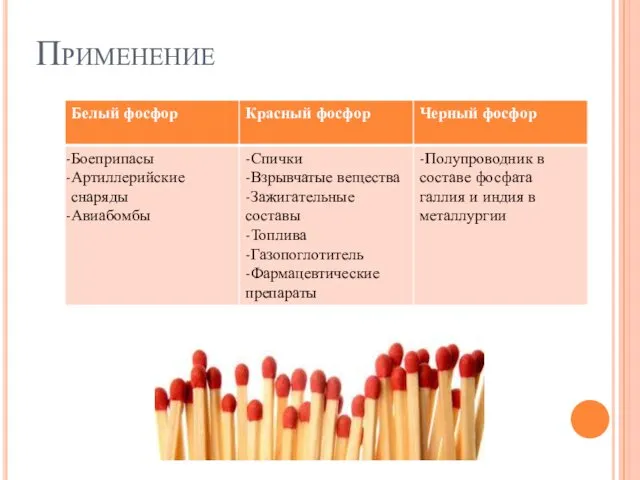
- 8. Применение
- 10. Химические свойства С простыми веществами: Фосфор легко окисляется кислородом: 4P + 5O2 = 2P2O5 4P +
- 11. С водой: Взаимодействует с водой, при этом диспропорционирует: 4Р + 6Н2О = РН3 + 3Н3РО2 С
- 12. Способы получения органопроизводных: Органические производные трехвалентного фосфора: 1. Действие металлорганических соединений (магния, лития) на трихлорид фосфора:
- 13. 4. Реакция прямого синтеза из элементного фосфора и галогеналкила в присутствии катализатора – металлической меди при
- 15. Скачать презентацию










 Включение учеников с расстройствами аутистического спектра и поведения в образование
Включение учеников с расстройствами аутистического спектра и поведения в образование На XX Международных духовно-образовательных Рождественских Чтениях
На XX Международных духовно-образовательных Рождественских Чтениях Интегрированная образовательная область с детьми второй младшей группы на тему: Этот День Победы!
Интегрированная образовательная область с детьми второй младшей группы на тему: Этот День Победы! Organs of the body
Organs of the body Основы архитектуры и строительных конструкций
Основы архитектуры и строительных конструкций презентация Мин яратам, сине Татарстан
презентация Мин яратам, сине Татарстан Канализация. Лас сулардың жіктелуі. Канализация немесе лас суды әкету мен лас суды тазарту дегеніміз
Канализация. Лас сулардың жіктелуі. Канализация немесе лас суды әкету мен лас суды тазарту дегеніміз Wiązania chemiczne
Wiązania chemiczne Нестандартные задачи, как средство формирования исследовательских умений обучающихся в курсе алгебры. (8 класс)
Нестандартные задачи, как средство формирования исследовательских умений обучающихся в курсе алгебры. (8 класс) Новый 2019 год. Поздравление питомца с Новым Годом
Новый 2019 год. Поздравление питомца с Новым Годом обобщающий урок по теме Африка 7 класс Своя игра
обобщающий урок по теме Африка 7 класс Своя игра Оборудование предприятий торговли. Торговое холодильное оборудование
Оборудование предприятий торговли. Торговое холодильное оборудование Урок китайского языка. 路
Урок китайского языка. 路 Шаблон для презентаций
Шаблон для презентаций Литературные места Крыма
Литературные места Крыма Компактные фотоаппараты Lumix
Компактные фотоаппараты Lumix Дорогой любимой дочери от папы
Дорогой любимой дочери от папы Тесто. Пышечка. 7 класс
Тесто. Пышечка. 7 класс Менингококковая инфекция
Менингококковая инфекция Изучаем память
Изучаем память Педагогический проект Если хочешь быть здоров Диск
Педагогический проект Если хочешь быть здоров Диск Лесная промышленность
Лесная промышленность Нагнетатели. Конструктивные элементы центробежных машин
Нагнетатели. Конструктивные элементы центробежных машин Разработка фрагмента календарного плана на тему: Краски осени первая младшая группа
Разработка фрагмента календарного плана на тему: Краски осени первая младшая группа Наши глаза помогают нам всегда
Наши глаза помогают нам всегда Формы и типы образования в педагогоике и андрогогике. Догматическое обучение
Формы и типы образования в педагогоике и андрогогике. Догматическое обучение Социальные сети: влияние на бренд,
Социальные сети: влияние на бренд, Мастер-класс.Изготовление пингвина из пластилина.
Мастер-класс.Изготовление пингвина из пластилина.