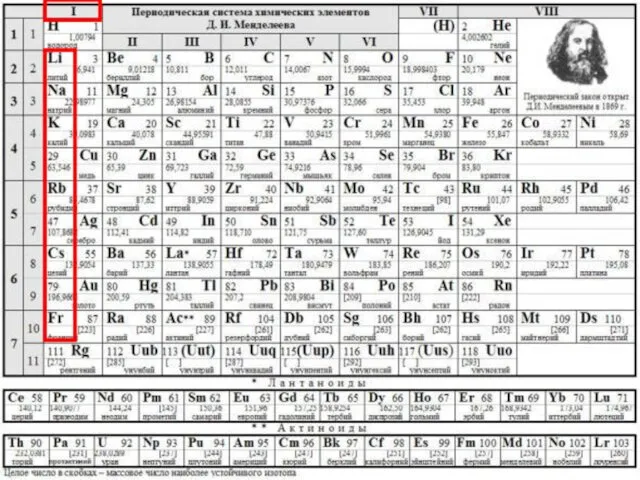
Общая характеристика элементов I группы главной подгруппы Периодической системы Д.И. Менделеева презентация
Содержание
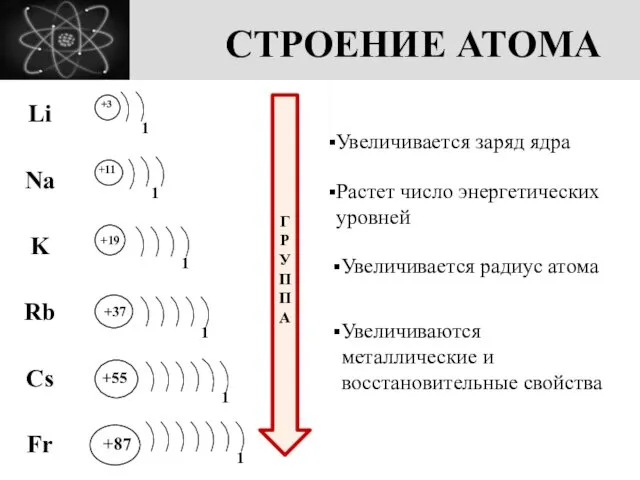
- 3. СТРОЕНИЕ АТОМА +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 ГРУППА Увеличивается
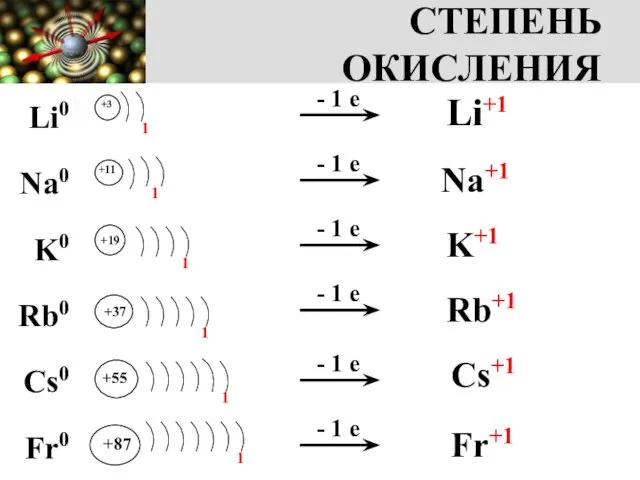
- 4. СТЕПЕНЬ ОКИСЛЕНИЯ +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 - 1
- 5. ЗАПОМНИ! Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1 NaOH, K2O,
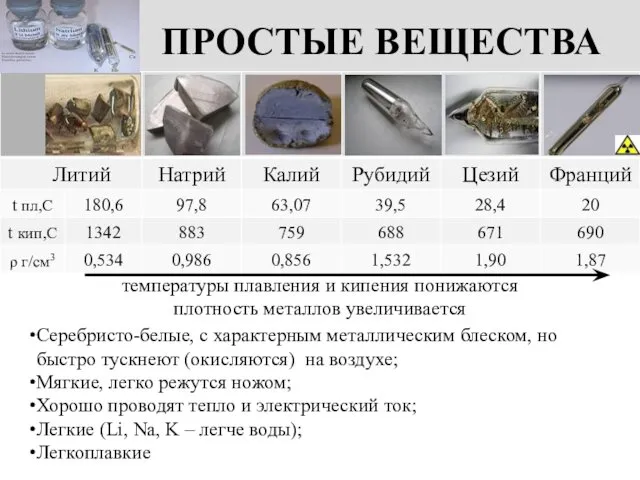
- 6. ПРОСТЫЕ ВЕЩЕСТВА Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе; Мягкие, легко режутся
- 7. ХИМИЧЕСКИЕ СВОЙСТВА Металлы I группы главной подгруппы – наиболее активные металлы, обладают высокой восстановительной способностью В
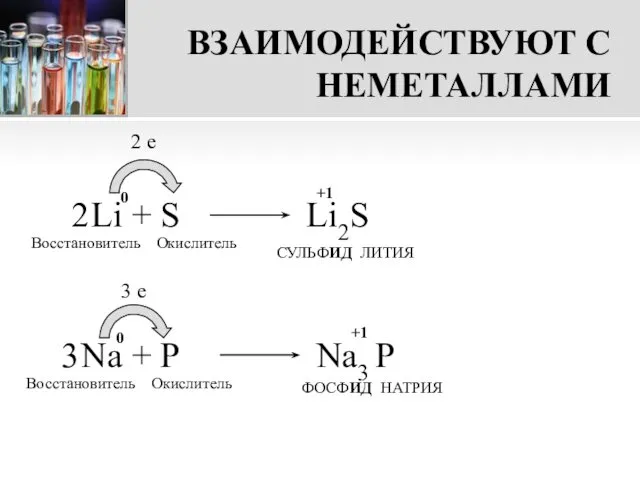
- 8. ВЗАИМОДЕЙСТВУЮТ С НЕМЕТАЛЛАМИ Li + S 2 e Восстановитель Окислитель СУЛЬФИД ЛИТИЯ Na + P 3
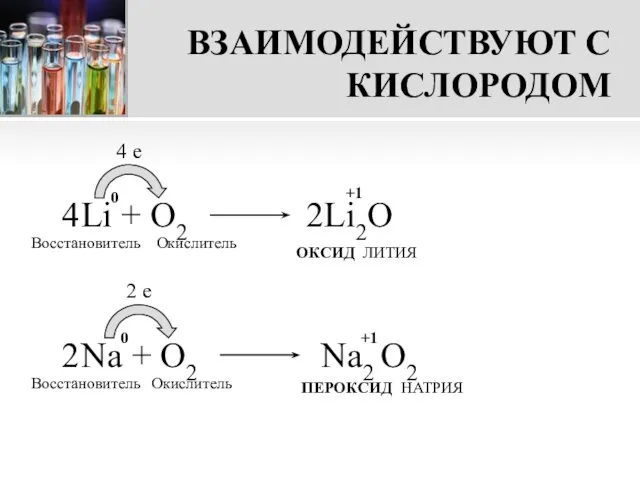
- 9. ВЗАИМОДЕЙСТВУЮТ С КИСЛОРОДОМ Li + О2 4 e Восстановитель Окислитель ОКСИД ЛИТИЯ Na + O2 2
- 10. ВНИМАНИЕ! При взаимодействии с кислородом только литий образует оксид. Другие металлы I группы главной подгруппы при
- 11. A ЗНАЕТЕ ЛИ ВЫ? При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию -
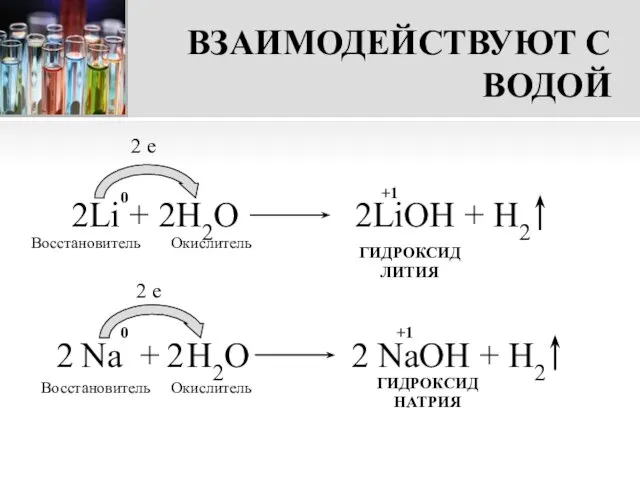
- 12. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В
- 13. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ 2Li + 2H2О 2LiOH + H2 2 e Восстановитель Окислитель ГИДРОКСИД ЛИТИЯ Восстановитель
- 14. ХРАНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят
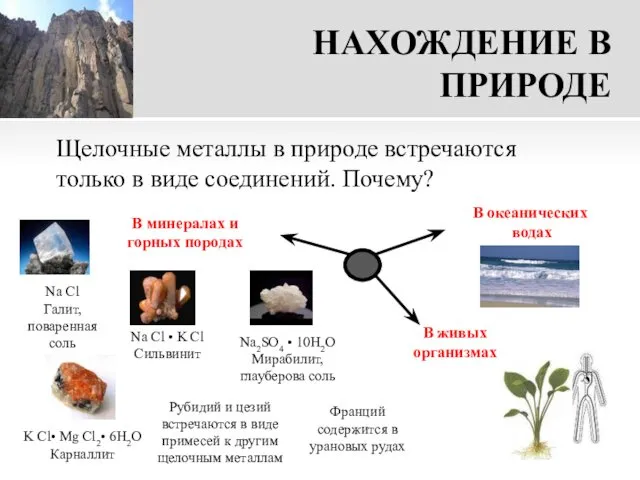
- 15. НАХОЖДЕНИЕ В ПРИРОДЕ Щелочные металлы в природе встречаются только в виде соединений. Почему? Na Cl Галит,
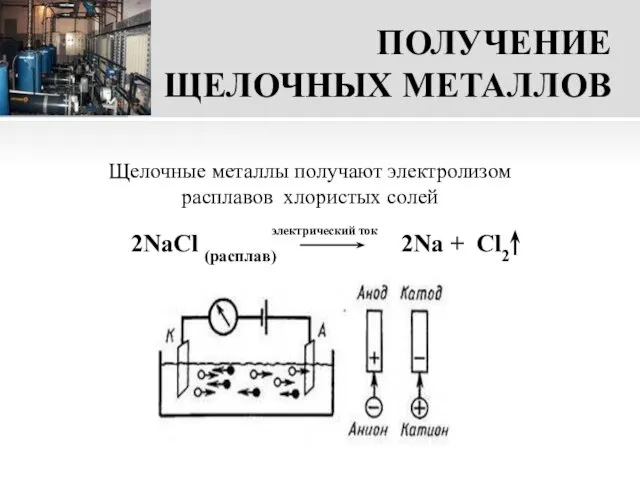
- 16. ПОЛУЧЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ 2NaCl (расплав) 2Na + Cl2 Щелочные металлы получают электролизом расплавов хлористых солей электрический
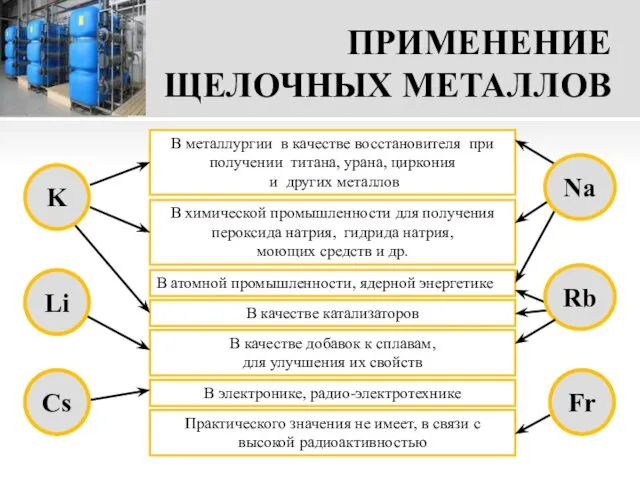
- 17. ПРИМЕНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ В металлургии в качестве восстановителя при получении титана, урана, циркония и других металлов
- 18. ИЗ ИСТОРИИ
- 19. ВЫБЕРИТЕ НЕВЕРНЫЕ СУЖДЕНИЯ О ЩЕЛОЧНЫХ МЕТАЛЛАХ: 1. Число электронов на внешнем энергетическом уровне щелочных металлов равно
- 20. ВЫБЕРИ ПРАВИЛЬНЫЙ ОТВЕТ 1. Щелочной металл a) Mg a) Ba a) Al a) Rb 2. Наиболее
- 21. НАЙДИ СООТВЕТСТВИЕ 1. Li 2. Na 3. K 4. Rb 5. Cs А) В атоме 6
- 23. Скачать презентацию










 MDI tech. Комплекс услуг по проектированию и мелкосерийному производству различных видов продукции
MDI tech. Комплекс услуг по проектированию и мелкосерийному производству различных видов продукции Сосудисто-тромбоцитарное звено системы гемостаза
Сосудисто-тромбоцитарное звено системы гемостаза Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса
Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса Народные восстания в эпоху Петра I
Народные восстания в эпоху Петра I Тип плоские черви
Тип плоские черви Десять основных положений нового закона Об образовании в РФ
Десять основных положений нового закона Об образовании в РФ Триединое единство. Презентация по курсу Брак и семья
Триединое единство. Презентация по курсу Брак и семья Строительство жилого трехэтажного кирпичного дома
Строительство жилого трехэтажного кирпичного дома химические свойства бензола
химические свойства бензола История болезни
История болезни Районный экологический фотоконкурс Мой родной Каширский край зимой
Районный экологический фотоконкурс Мой родной Каширский край зимой Обработка спинки женского пальто
Обработка спинки женского пальто Разработка технологических процессов и проектирование изделий
Разработка технологических процессов и проектирование изделий ФГТ В ДОУ
ФГТ В ДОУ Скелет человека
Скелет человека 20231008_maslenitsa1
20231008_maslenitsa1 Классный уголок
Классный уголок Водный орех (чилим)
Водный орех (чилим) Тепломассообмен в биосфере. Введение, некоторые математические понятия
Тепломассообмен в биосфере. Введение, некоторые математические понятия Реализация приоритетного проекта Формирование комфортной городской среды на территории МО Заостровское на 2018 год
Реализация приоритетного проекта Формирование комфортной городской среды на территории МО Заостровское на 2018 год Настольные игры
Настольные игры konflikt_prezentatsiya
konflikt_prezentatsiya Авиакомпания Аэрофлот
Авиакомпания Аэрофлот Я - воспитатель
Я - воспитатель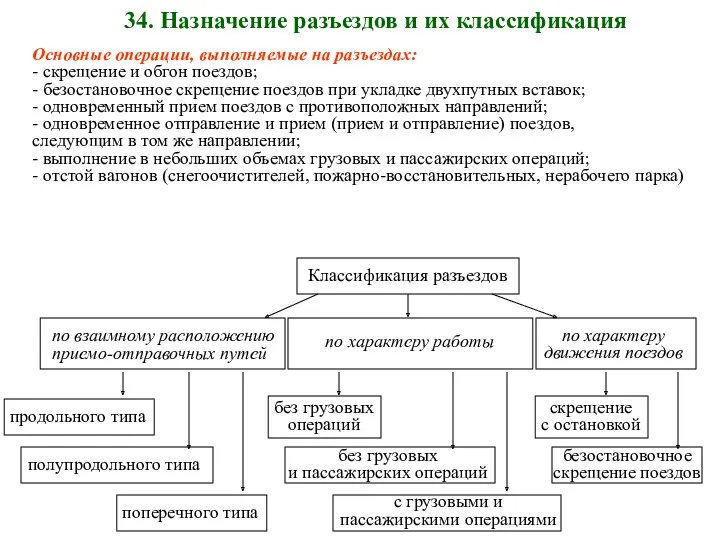 Назначение разъездов и их классификация
Назначение разъездов и их классификация Викторина
Викторина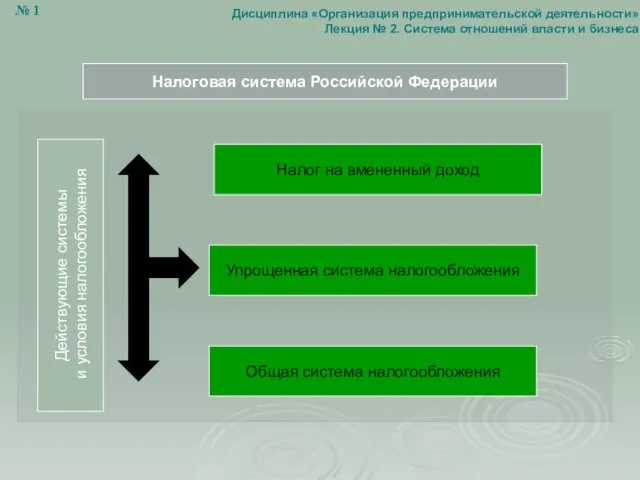 Система отношений власти и бизнеса. (Лекция 2)
Система отношений власти и бизнеса. (Лекция 2) Акция 7+1 Петровская Слобода
Акция 7+1 Петровская Слобода