Содержание
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
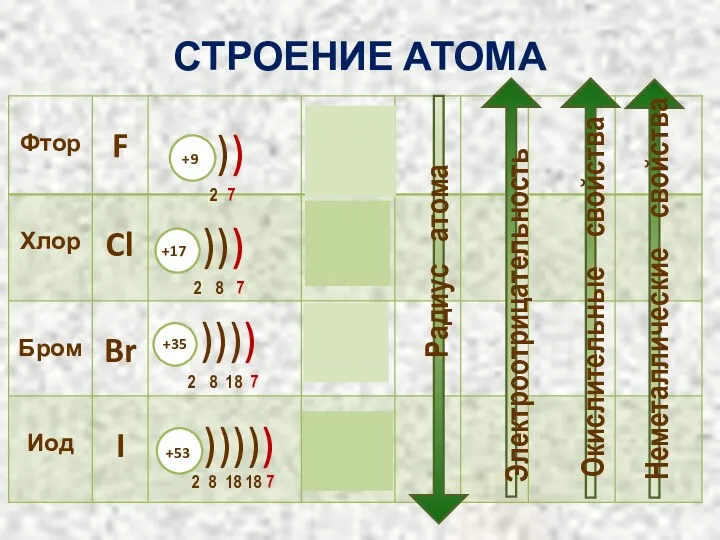
- 3. СТРОЕНИЕ АТОМА
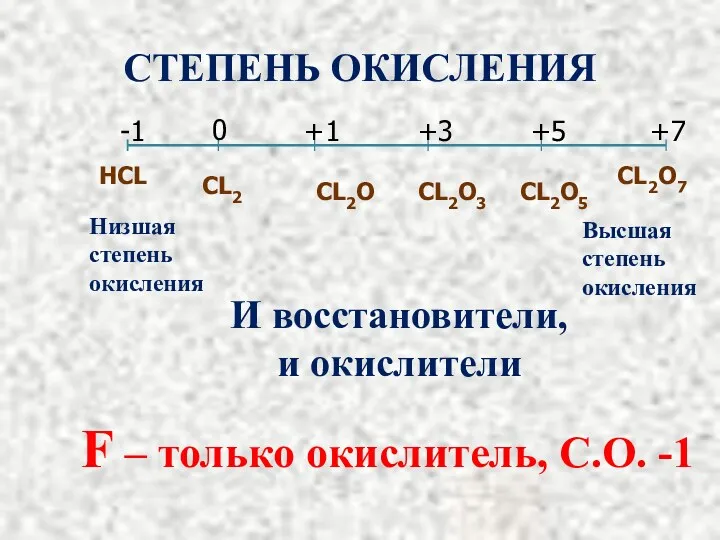
- 4. СТЕПЕНЬ ОКИСЛЕНИЯ НCL CL2O7 F – только окислитель, С.О. -1 -1 0 +1 +3 +5 +7
- 5. Молекулы галогенов состоят из двух атомов Связь – ковалентная неполярная СТРОЕНИЕ МОЛЕКУЛ
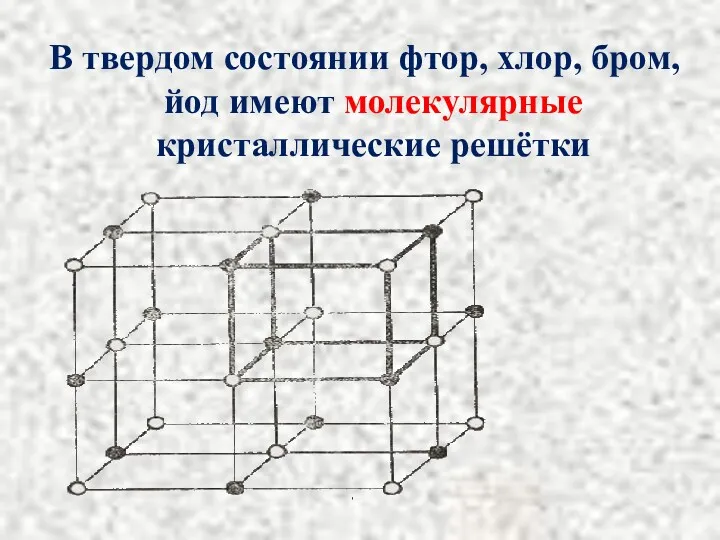
- 6. В твердом состоянии фтор, хлор, бром, йод имеют молекулярные кристаллические решётки
- 7. Простые вещества - галогены
- 8. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
- 9. H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 +
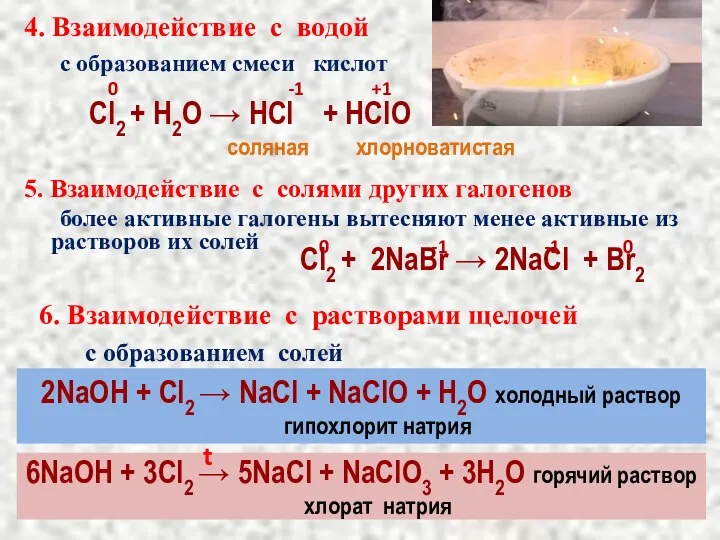
- 10. 4. Взаимодействие с водой с образованием смеси кислот 5. Взаимодействие с солями других галогенов более активные
- 11. В промышленности: синтезом из водорода и хлора: H2 + Cl2 = 2HCl 2) В лаборатории: NaCl
- 12. Физические свойства: бесцветная, дымящая на воздухе жидкость, тяжелее воды Химические свойства: Типичная кислота Соляная кислота С
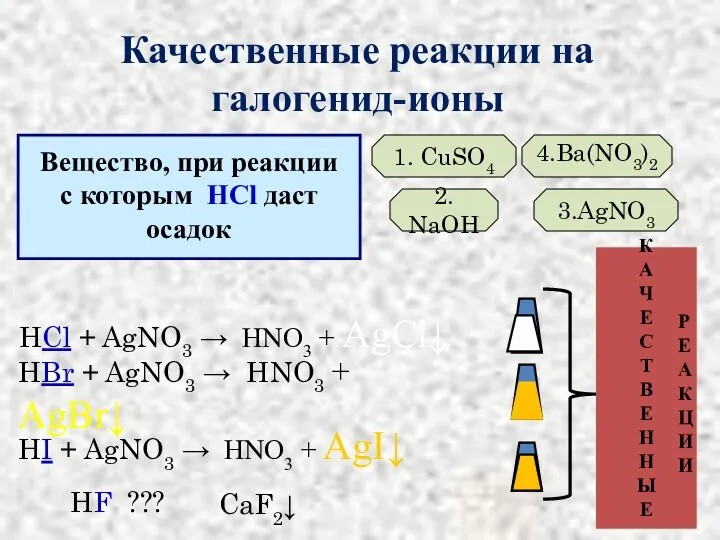
- 13. Вещество, при реакции с которым HCl даст осадок 1. CuSO4 2. NaOH 3.AgNO3 4.Ba(NO3)2 HCl +
- 15. Скачать презентацию







 Процес виготовлення книги. Застосування шаблону, штампу, трафарету
Процес виготовлення книги. Застосування шаблону, штампу, трафарету Определение степени с целым показателем
Определение степени с целым показателем Виртуальный парк аттракционов: VirtuReal Park
Виртуальный парк аттракционов: VirtuReal Park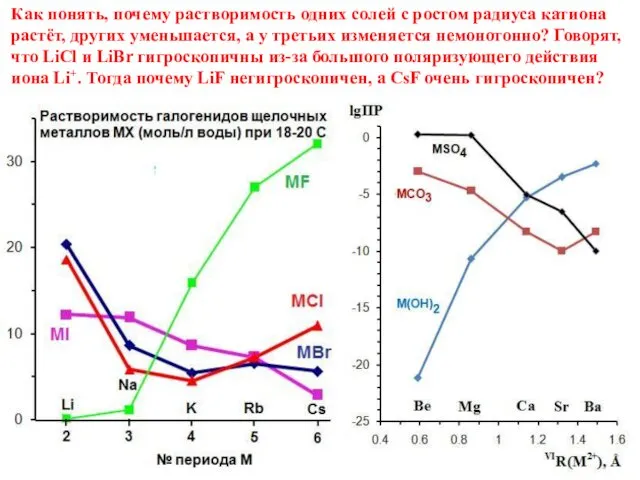 Растворимость галогенидов щелочных металлов
Растворимость галогенидов щелочных металлов Географические координаты. Градусная сетка. Свойства линий градусной сетки
Географические координаты. Градусная сетка. Свойства линий градусной сетки Детское экспериментирование - путь познания окружающего мира
Детское экспериментирование - путь познания окружающего мира Что такое светская этика
Что такое светская этика ДЕТИ ВОЙНЫ
ДЕТИ ВОЙНЫ Социальная виктимология
Социальная виктимология Обязательные страховые взносы в бюджет государственного внебюджетного фонда социальной защиты (ФСЗН)
Обязательные страховые взносы в бюджет государственного внебюджетного фонда социальной защиты (ФСЗН) Стародавня Індія
Стародавня Індія Презентация Герои Курской дуги
Презентация Герои Курской дуги Поклонимся великим тем годам...
Поклонимся великим тем годам... Проект доступной среды для хостела Морюшко
Проект доступной среды для хостела Морюшко Изготовление картин из цветного опила
Изготовление картин из цветного опила Развитие Танцевального товрчества у старших дошкольников
Развитие Танцевального товрчества у старших дошкольников Номинальные напряжения в системах электроснабжения городов
Номинальные напряжения в системах электроснабжения городов Лесной комплекс
Лесной комплекс Формування естетичного ставлення до мистецтва хореографії засобами українського народного танцю
Формування естетичного ставлення до мистецтва хореографії засобами українського народного танцю Past tenses
Past tenses Благоустройство участка дороги к зоне отдыха Лукоморье, установка уличного освещени
Благоустройство участка дороги к зоне отдыха Лукоморье, установка уличного освещени Книгуру. Всероссийский конкурс на лучшее литературное произведение для детей и юношества
Книгуру. Всероссийский конкурс на лучшее литературное произведение для детей и юношества Увлекательное рукоделие
Увлекательное рукоделие Презентация по теме ЧС техногенного характера
Презентация по теме ЧС техногенного характера The system of ranks in Ukrainian police and American (British) police
The system of ranks in Ukrainian police and American (British) police Презентация Сенсорное развитие дошкольников посредством танцевально - игровой деятельности
Презентация Сенсорное развитие дошкольников посредством танцевально - игровой деятельности От мудрости Востока к европейской христианской культуре: Библия
От мудрости Востока к европейской христианской культуре: Библия Гносеология, или Теория познания
Гносеология, или Теория познания