Содержание
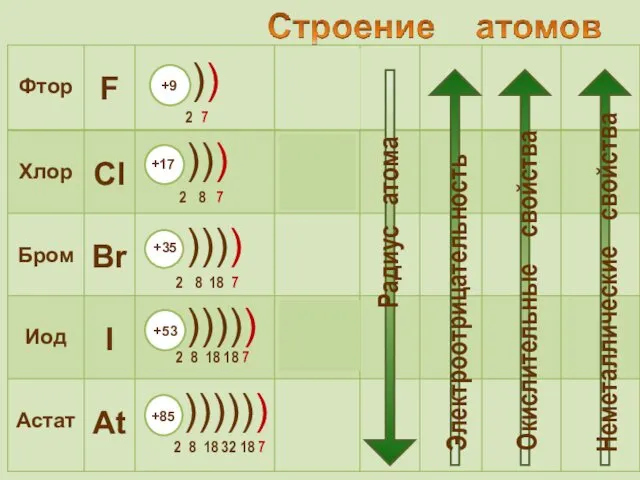
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. В свободном виде не встречаются
- 4. Галит NaCl
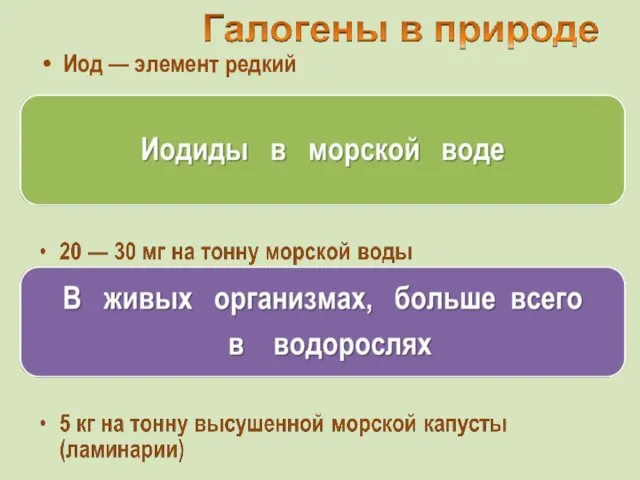
- 6. Иод — элемент редкий
- 9. Фтор История открытия галогенов Хлор Бром Йод Астат
- 10. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 11. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 12. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 13. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 14. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
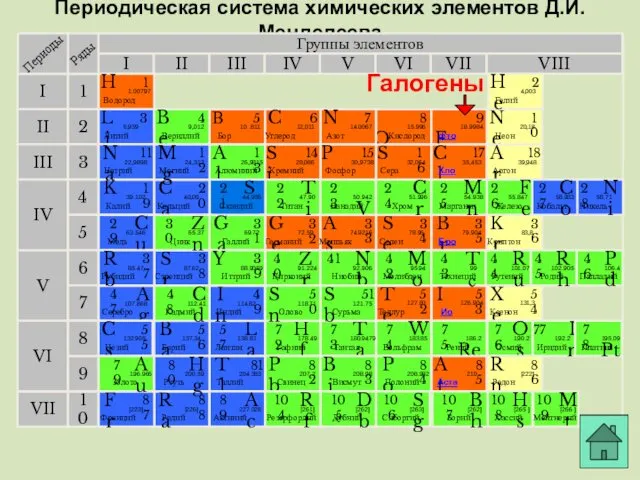
- 15. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 16. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 17. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 18. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 19. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 20. Группы элементов I III II VIII IV V VI VII II I III VII VI V
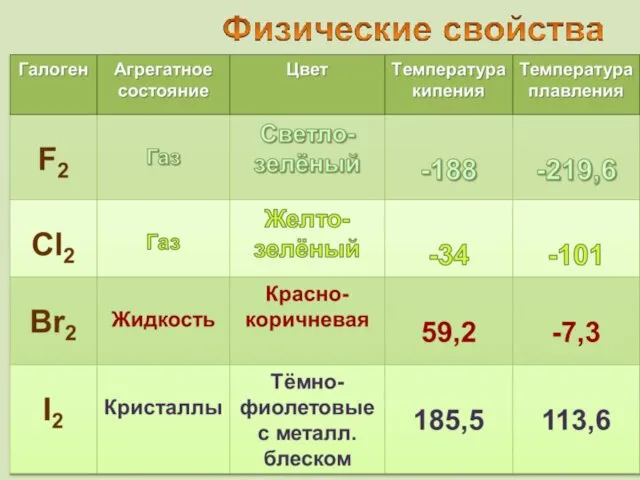
- 21. Название "фтор" (от греческого phthoros - разрушение, гибель) Ни один из химических элементов не принес химикам
- 22. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
- 23. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79Вr (50,56%) 81Вr (49,44%) пары
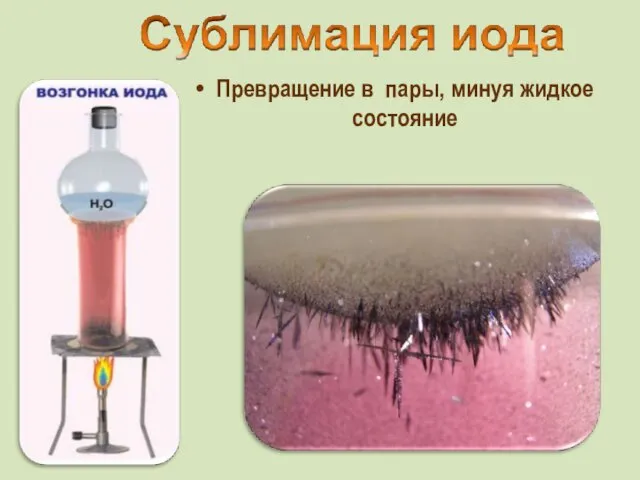
- 24. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 25. Превращение в пары, минуя жидкое состояние
- 26. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
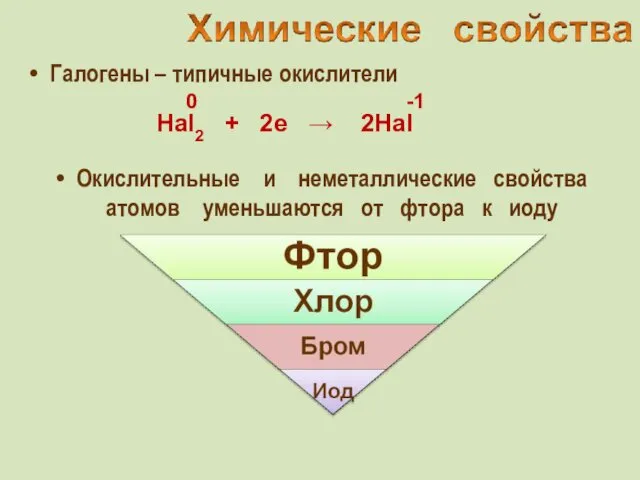
- 27. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
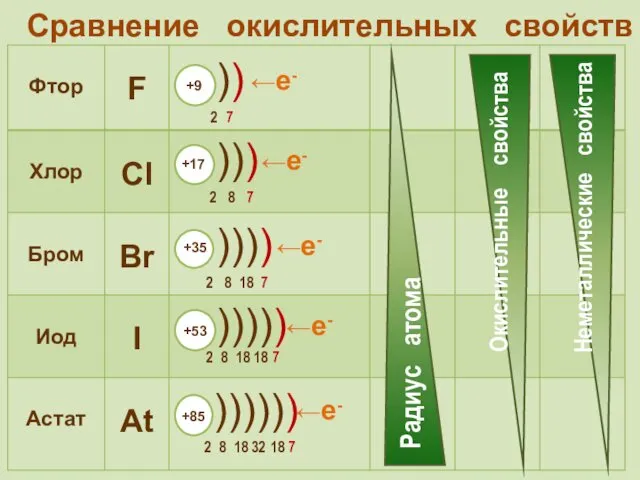
- 28. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
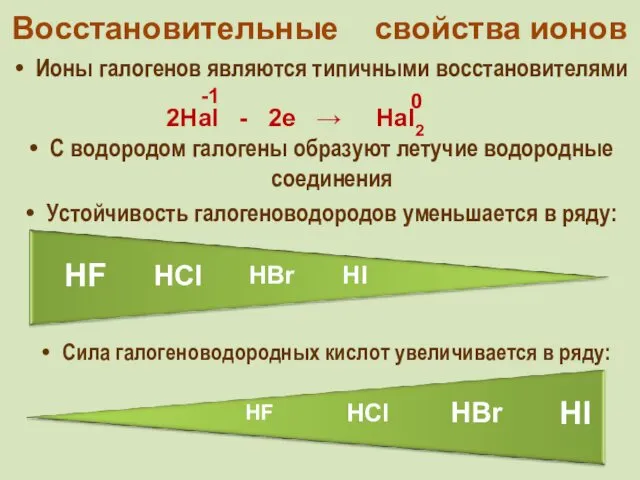
- 29. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
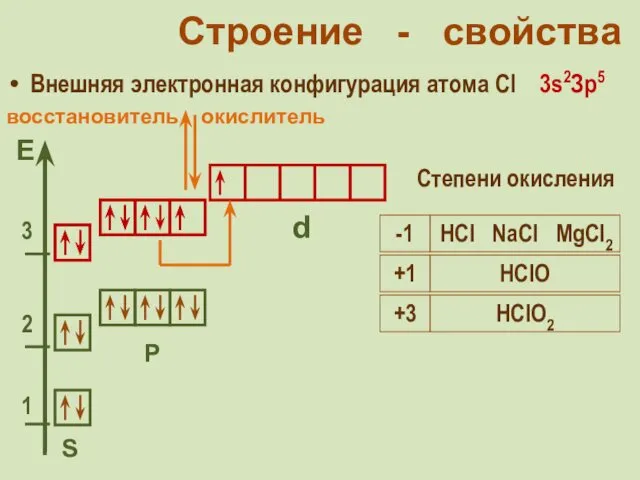
- 30. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления окислитель -1
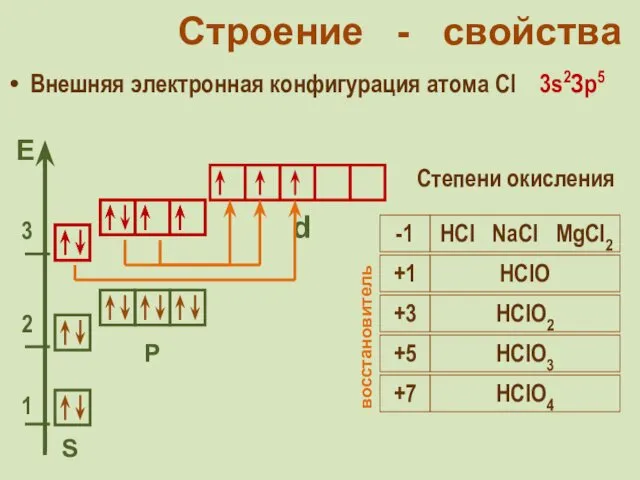
- 31. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления -1 HCl
- 32. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
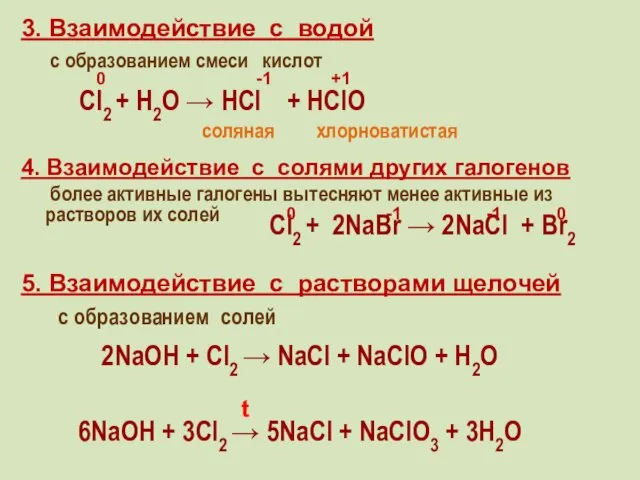
- 33. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 34. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
- 35. производство соляной кислоты
- 36. - 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и
- 37. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 38. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 39. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 40. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 41. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
- 42. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 →
- 43. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 44. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 45. Что значит название «Галогены»? В чём сходство электронного строения этих элементов? Какие свойства в окислительно-восстановительном плане
- 47. Скачать презентацию
































 10 шагов составления эффективных презентаций Powerpoint
10 шагов составления эффективных презентаций Powerpoint 0 (12 files merged)
0 (12 files merged) Быть здоровым - это модно.
Быть здоровым - это модно. Технология обработки продукта убоя для производства мясных изделий
Технология обработки продукта убоя для производства мясных изделий Конспект интегрированного урока (химии, географии, биологии) в 8 класс по теме: Атмосферный озон. Вред и польза.
Конспект интегрированного урока (химии, географии, биологии) в 8 класс по теме: Атмосферный озон. Вред и польза. Сборочное производство в структуре завода. Основные направления в совершенствование сборочного производства
Сборочное производство в структуре завода. Основные направления в совершенствование сборочного производства Новые инструменты продвижения в социальных сетях. SMM-агентство GreenPR
Новые инструменты продвижения в социальных сетях. SMM-агентство GreenPR Уход за волосами. Шампуни и кондиционеры
Уход за волосами. Шампуни и кондиционеры Лечение туберкулеза легких
Лечение туберкулеза легких Рабочие органы хоппер-дозаторов и вагонов-самосвалов
Рабочие органы хоппер-дозаторов и вагонов-самосвалов Ижтимоий фанлар кафедраси диннинг моҳияти, тузилиш ва функциялари тайёрлади: н.холмирзаев, ж,холмирзаева фарғона 2019
Ижтимоий фанлар кафедраси диннинг моҳияти, тузилиш ва функциялари тайёрлади: н.холмирзаев, ж,холмирзаева фарғона 2019 Влияние магнитных бурь на здоровье человека
Влияние магнитных бурь на здоровье человека Программа Нұрлы Жер. Новые направления жилищного строительства
Программа Нұрлы Жер. Новые направления жилищного строительства Музыкальное воспитание и развитие детей дошкольного возраста в контексте современных концепций детства
Музыкальное воспитание и развитие детей дошкольного возраста в контексте современных концепций детства Вехи развития атомной энергетики
Вехи развития атомной энергетики Классный час на тему: Суд над человеком
Классный час на тему: Суд над человеком Контроль сопротивления изоляции сети и электроприёмников
Контроль сопротивления изоляции сети и электроприёмников Моя малая родина-Кантемировка
Моя малая родина-Кантемировка Заповедник Столбы
Заповедник Столбы Теорема Менелая
Теорема Менелая Портфолио ученика начальной школы. Презентация.
Портфолио ученика начальной школы. Презентация. Современные тренды городского электрического транспорта. Обеспечение предприятий ГЭТ России новым подвижным составом
Современные тренды городского электрического транспорта. Обеспечение предприятий ГЭТ России новым подвижным составом Каждый день на устах моих Это сладкое имя Иисус
Каждый день на устах моих Это сладкое имя Иисус Зачем я учусь в школе?
Зачем я учусь в школе? Дополнительный материал:
Дополнительный материал: Роль артикуляционной гимнастики в речевом развитии детей
Роль артикуляционной гимнастики в речевом развитии детей Технические средства телекоммуникационных технологий
Технические средства телекоммуникационных технологий Умный текстиль
Умный текстиль