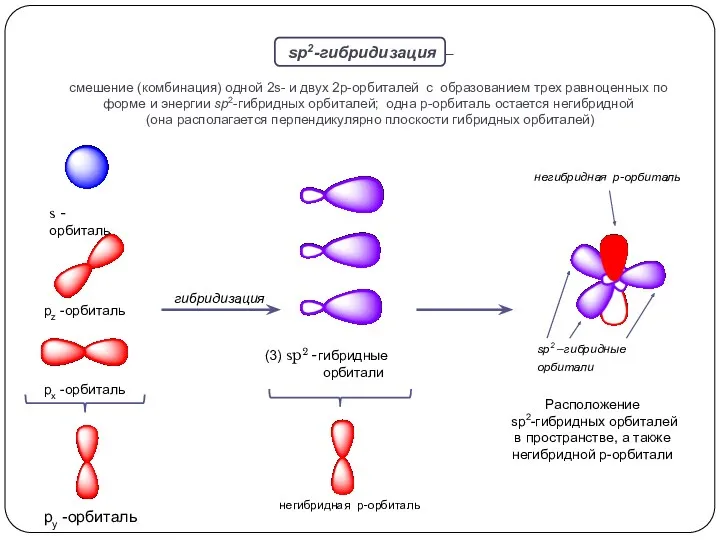
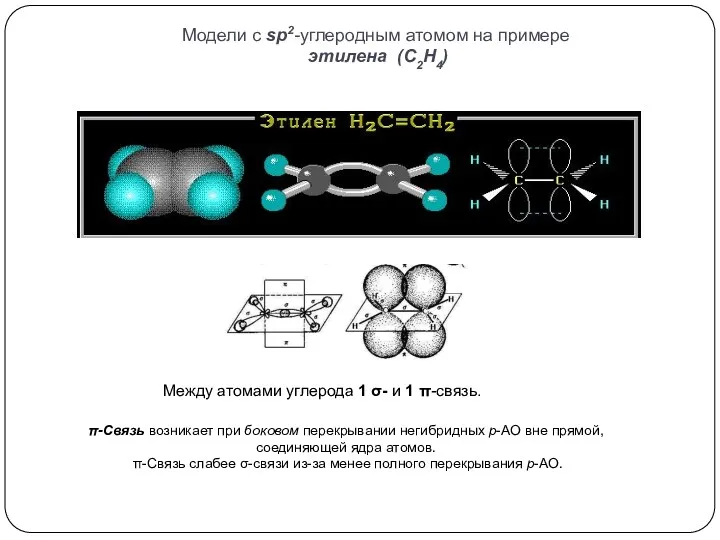
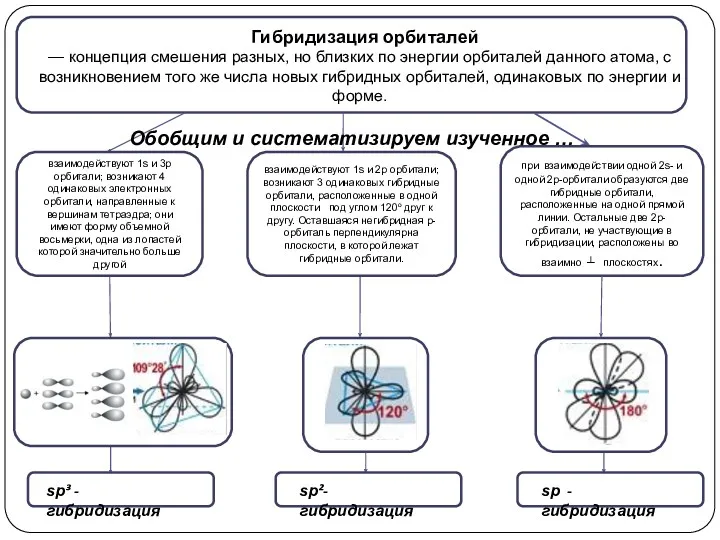
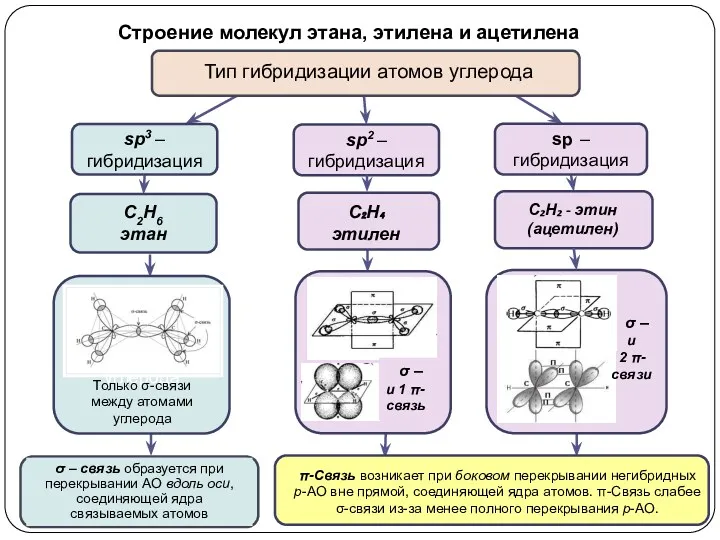
взаимодействуют 1s и 2p орбитали; возникают 3 одинаковых гибридные орбитали, расположенные
в одной плоскости под углом 120о друг к другу. Оставшаяся негибридная р-орбиталь перпендикулярна плоскости, в которой лежат гибридные орбитали.
взаимодействуют 1s и 3p орбитали; возникают 4 одинаковых электронных орбитали, направленные к вершинам тетраэдра; они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой
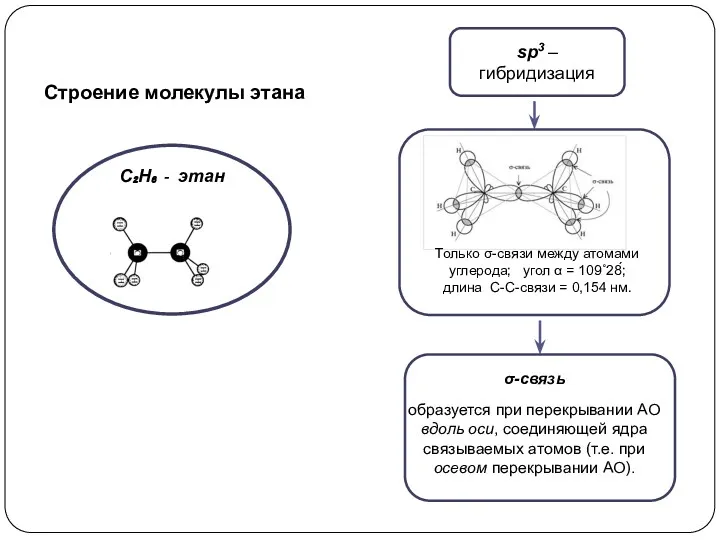
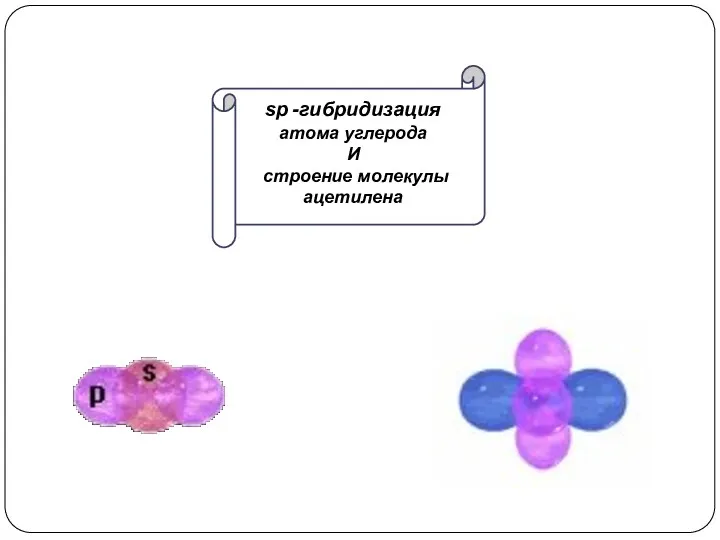
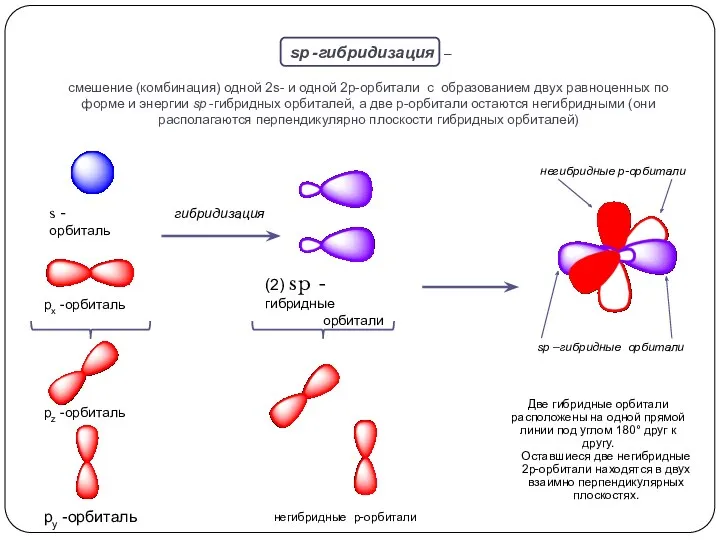
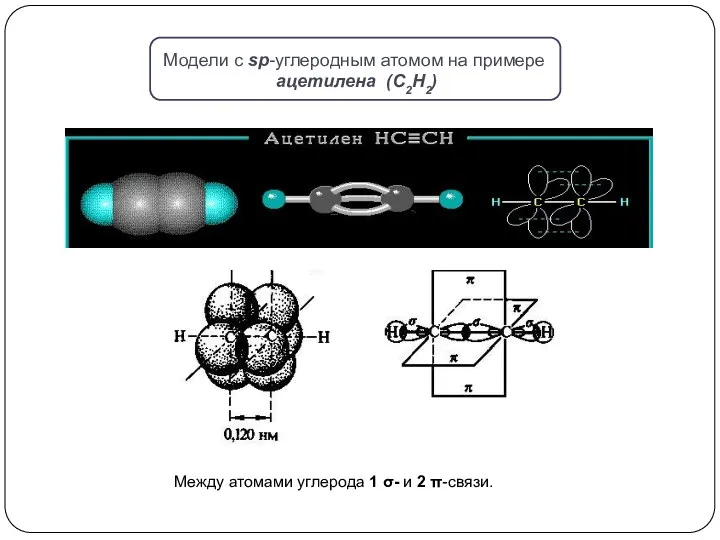
при взаимодействии одной 2s- и одной 2р-орбитали образуются две гибридные орбитали, расположенные на одной прямой линии. Остальные две 2р-орбитали, не участвующие в гибридизации, расположены во взаимно ┴ плоскостях.
Обобщим и систематизируем изученное …


 Италия и Германия в XII - XV веках
Италия и Германия в XII - XV веках Симптомокомплексы при заболеваниях органов дыхания
Симптомокомплексы при заболеваниях органов дыхания Бульвар Генерала Карбышева
Бульвар Генерала Карбышева Автомобильные дороги, аэродромы и объекты транспортной инфраструктуры
Автомобильные дороги, аэродромы и объекты транспортной инфраструктуры Деление на десятичную дробь
Деление на десятичную дробь Определение показателей прочности грунта (угла внутреннего трения и удельного сцепления) в приборе одноплоскосного среза
Определение показателей прочности грунта (угла внутреннего трения и удельного сцепления) в приборе одноплоскосного среза Туркестанская область
Туркестанская область Развитие фонематического слуха у детей старшего дошкольного возраста
Развитие фонематического слуха у детей старшего дошкольного возраста Палиндромы и рестриктазы
Палиндромы и рестриктазы Викторина Угадай слово
Викторина Угадай слово Дидактическая игра как средство развития коммуникативных навыков у детей старшего дошкольного возраста
Дидактическая игра как средство развития коммуникативных навыков у детей старшего дошкольного возраста История информационных войн (лекция № 2)
История информационных войн (лекция № 2) Этикет поведенияза столом.
Этикет поведенияза столом. Мусульманство в России
Мусульманство в России Школа астрологии Елены Черных
Школа астрологии Елены Черных Архитектура информационных систем. Элементы бизнес-архитектуры и ИТ-архитектуры. Лекция 3
Архитектура информационных систем. Элементы бизнес-архитектуры и ИТ-архитектуры. Лекция 3 Предыстория христианства: иудаизм от зарождения до Эпохи Второго храма
Предыстория христианства: иудаизм от зарождения до Эпохи Второго храма Педагогическое кредо
Педагогическое кредо 20230212_7_tri_sostoyaniya_veshchestva
20230212_7_tri_sostoyaniya_veshchestva Библейские сказания. История Древнего мира
Библейские сказания. История Древнего мира ПДД 6
ПДД 6 Производственные процессы в рыбоводстве
Производственные процессы в рыбоводстве Проект Год 1941-1945...
Проект Год 1941-1945... Автомобилестроение
Автомобилестроение Сільське господарство світу
Сільське господарство світу Современная деревянная архитектура и традиции
Современная деревянная архитектура и традиции Приемы и техники массажа. Движение
Приемы и техники массажа. Движение Презентация к родительскому собранию.
Презентация к родительскому собранию.