Слайд 2

Гидролиз – это взаимодействие с молекулами воды.
Гидролиз – это процесс, при
котором молекулы воды, взаимодействуя с ионами растворенного вещества, разлагаются с выделением ионов водорода или гидроксид-ионов, в результате чего изменяется рН раствора.
Слайд 3

Гидролизу подвергаются соли:
образованные слабым основанием и сильной кислотой NH4Cl, N2H4·HCl
образованные сильным
основанием и слабой кислотой CH3COONa, C6H5COOK
образованные слабым основанием и слабой кислотой
Слайд 4

Расчет константы гидролиза Kh, pH и степени гидролиза h соли, образованной
сильным основанием и слабой кислотой
BA → B+ + A–
A– + H2O → HA + OH–
[HA] · [OH–]
Kh = ——————
[A–]
Слайд 5
![[HA] · [OH–] [H+] Kw Kh = —————— · ———](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-4.jpg)
[HA] · [OH–] [H+] Kw
Kh = —————— · ——— = ———
[A–] [H+] Kк-ты
[HA] · [OH–] Kw
—————— = ———
[A–] Kк-ты
[HA] = [OH–]
[A–] = Ссоли – [OH–] ≈ Ссоли
(h < 5%)
Слайд 6
![[OH–]2 Kw ———— = ——— Ссоли Kк-ты pOH = ½](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-5.jpg)
[OH–]2 Kw
———— = ———
Ссоли Kк-ты
pOH = ½ pKw
– ½ pKк-ты – ½ lg Cсоли
pOH = 7 – ½ pKк-ты – ½ lg Cсоли
pH = 7 + ½ pKк-ты + ½ lg Cсоли
Слайд 7
![Cгидр [OH–] h = ———— = ———— Ссоли Ссоли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-6.jpg)
Cгидр [OH–]
h = ———— = ————
Ссоли Ссоли
Слайд 8

Стенень гидролиза зависит от:
Ионного произведения воды
(чем ↑ to ⎯
тем ↑ Kw ⎯ тем ↑ h)
2. Природы кислоты
(чем слабее кислота, тем в большей степени протекает гидролиз)
3. Концентрации соли
(чем ↓ Ссоли ⎯ тем ↑ h)
Слайд 9

Расчет константы гидролиза Kh, pH и степени гидролиза h соли, образованной
слабым основанием и сильной кислотой
BA → B+ + A–
B+ + H2O → BOH + H+
[BOH] · [H+]
Kh = ——————
[B+]
Слайд 10
![[BOH] · [H+] [OH–] Kw Kh = —————— · ———](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-9.jpg)
[BOH] · [H+] [OH–] Kw
Kh = —————— · ——— = ———
[B+] [OH–] Kосн
[BOH] · [H+] Kw
—————— = ———
[B+] Kосн
[BOH] = [H+]
[B+] = Ссоли – [H+] ≈ Ссоли
(h < 5%)
Слайд 11
![[H+] 2 Kw ———— = ——— Ссоли Kосн pH =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-10.jpg)
[H+] 2 Kw
———— = ———
Ссоли Kосн
pH = ½
pKw – ½ pKосн – ½ lg Cсоли
pH = 7 – ½ pKосн – ½ lg Cсоли
Слайд 12
![Cгидр [H+] h = ———— = ———— Ссоли Ссоли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-11.jpg)
Cгидр [H+]
h = ———— = ————
Ссоли Ссоли
Слайд 13

Стенень гидролиза зависит от:
Ионного произведения воды
(чем ↑ to ⎯
тем ↑ Kw ⎯ тем ↑ h)
2. Природы основания
(чем слабее основание, тем в большей степени протекает гидролиз)
3. Концентрации соли
(чем ↓ Ссоли ⎯ тем ↑ h)
Слайд 14

Расчет константы гидролиза Kh, pH и степени гидролиза h соли, образованной
слабым основанием и слабой кислотой
BA → B+ + A–
B+ + A– + H2O → BOH + HA
[BOH] · [HA]
Kh = ——————
[B+] · [A–]
Слайд 15
![[BOH] · [HA] [OH–] [H+] Kw Kh = —————— ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-14.jpg)
[BOH] · [HA] [OH–] [H+] Kw
Kh = —————— · ——
· —— = ————
[B+] · [A–] [OH–] [H+] Kк-ты · Kосн
[BOH] · [HA] Kw
—————— = ————
[B+] · [A–] Kк-ты · Kосн
[BOH] = [HA]
[B+] = Ссоли – [H+] ≈ Ссоли
[A–] = Ссоли – [OH–] ≈ Ссоли
(h < 5%)
Слайд 16
![[HA] 2 Kw ———— = ———— Ссоли2 Kк-ты · Kосн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-15.jpg)
[HA] 2 Kw
———— = ————
Ссоли2 Kк-ты · Kосн
Выразим
[HA] через [H+]
HA → H+ + A–
[H +] · [A–]
Kк-ты = ——————
[HA]
[A–] = Ссоли
[H +] · Ссоли
[HA] = ——————
Kк-ты
Слайд 17
![[HA] 2 Kw ———— = ———— Ссоли2 Kк-ты · Kосн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-16.jpg)
[HA] 2 Kw
———— = ————
Ссоли2 Kк-ты · Kосн
[H +]
· Ссоли
[HA] = ——————
Kк-ты
[H +]2 · Ссоли2 Kw
—————— = ————
Kк-ты2 · Ссоли2 Kк-ты · Kосн
[H +]2 Kw
———— = ———
Kк-ты Kосн
Слайд 18
![Kw · Kк-ты [H+]2 = —————— Kосн pH = ½](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-17.jpg)
Kw · Kк-ты
[H+]2 = ——————
Kосн
pH =
½ pKw + ½ pKк-ты – ½ pKосн
pH = 7 + ½ pKк-ты – ½ pKосн
Слайд 19

Степень гидролиза соли зависит от ионного произведения воды, силы кислоты и
силы основания
Слайд 20

Вычислить рН и степень гидролиза 0,35% раствора солянокислого гидразина N2H4·HCl
pH =
7 – ½ pKосн – ½ lg Cсоли
pKосн = 6,03 пересчитаем 0,35% = 0,05 М
pH = 7 – ½ · 6,03 – ½ · lg 0,05 = 4,63
или 0,04%
Слайд 21

Равновесия в растворах
кислых солей (NaHCO3)
Слайд 22

MHA → M+ + HA– α > 30%
? ?
HA–
+ H+ → H2A HA– → H+ + A2–
[H+] = [A2–] – [H2A]
H2A → H+ + HA– HA– → H+ + A2–
[H+] · [HA– ] [H+] · [A2– ]
K1 = ————— K2 = —————
[H2A] [HA– ]
Слайд 23
![[HA– ] = Cсоли [H+] · Cсоли [H+] · [A2–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-22.jpg)
[HA– ] = Cсоли
[H+] · Cсоли [H+] · [A2– ]
K1 = ————— K2 = —————
[H2A] Cсоли
[H+] · Cсоли K2 · Cсоли
[H2A] = ————— [A2– ] = —————
K1 [H+]
[H+] = [A2–] – [H2A]
K2 · Cсоли [H+] · Cсоли
[H+] = ————— – —————
[H+] K1
Слайд 24
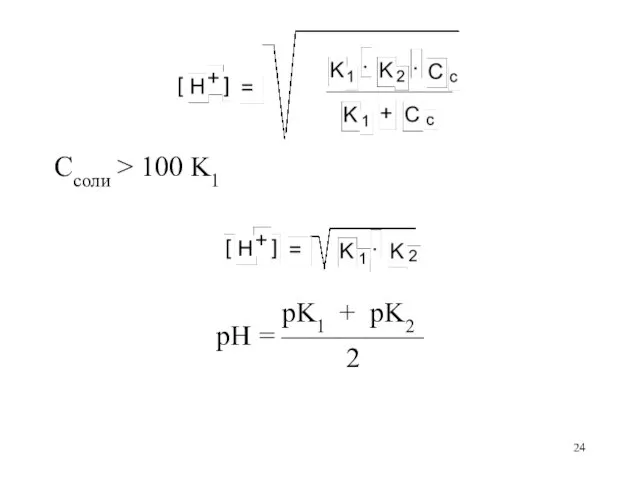
Cсоли > 100 K1
pK1 + pK2
pH = —————
2
Слайд 25

Вычислить рН раствора гидрокарбоната натрия.
NaHCO3 – кислая соль pK1 = 6,35
pK2 = 10,32
pK1 + pK2
pH = —————
2
6,35 + 10,32
pH = —————— = 8,3
2
Слайд 26

К 50 мл 0,1 М раствора Na2CO3 добавлено 25 мл 0,2
М раствора HCl. Вычислить рН раствора.
Na2CO3 + HCl → NaHCO3 + NaCl
Na2CO3 + 2HCl → H2CO3 + 2NaCl
ν (Na2CO3) = C(Na2CO3) · V = 50 · 0,1 = 0,5 мМ
ν (HCl) = C(HCl) · V = 25 · 0,2 = 0,5 мМ



![[HA] · [OH–] [H+] Kw Kh = —————— · ———](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-4.jpg)
![[OH–]2 Kw ———— = ——— Ссоли Kк-ты pOH = ½](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-5.jpg)
![Cгидр [OH–] h = ———— = ———— Ссоли Ссоли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-6.jpg)


![[BOH] · [H+] [OH–] Kw Kh = —————— · ———](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-9.jpg)
![[H+] 2 Kw ———— = ——— Ссоли Kосн pH =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-10.jpg)
![Cгидр [H+] h = ———— = ———— Ссоли Ссоли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-11.jpg)


![[BOH] · [HA] [OH–] [H+] Kw Kh = —————— ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-14.jpg)
![[HA] 2 Kw ———— = ———— Ссоли2 Kк-ты · Kосн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-15.jpg)
![[HA] 2 Kw ———— = ———— Ссоли2 Kк-ты · Kосн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-16.jpg)
![Kw · Kк-ты [H+]2 = —————— Kосн pH = ½](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-17.jpg)




![[HA– ] = Cсоли [H+] · Cсоли [H+] · [A2–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53033/slide-22.jpg)



 Праздники народов России. 4 класс
Праздники народов России. 4 класс Александр Александрович Фадеев 1901 - 1956
Александр Александрович Фадеев 1901 - 1956 Школьный этикет. Правила поведения на уроке.
Школьный этикет. Правила поведения на уроке. Рождественская звезда . Рождение Иисуса
Рождественская звезда . Рождение Иисуса TCU (traffic control unit)
TCU (traffic control unit) Именные химические реакции в органической химии
Именные химические реакции в органической химии Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Ярослав Гашек Камень жизни
Ярослав Гашек Камень жизни Научные принципы, параметры технологии и технологическое оборудование для прямой переработки кусковой сидеритовой руды в сталь
Научные принципы, параметры технологии и технологическое оборудование для прямой переработки кусковой сидеритовой руды в сталь Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы
Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы Экономика и экология
Экономика и экология Презентация Игровые технологии в детском саду Игровые технологии в ДОУ
Презентация Игровые технологии в детском саду Игровые технологии в ДОУ Кадры предприятия. (Тема 9)
Кадры предприятия. (Тема 9) Моральное стимулирование труда персонала
Моральное стимулирование труда персонала 20190306_larina_n.p
20190306_larina_n.p Характеристика элементов III A группы. Бор и алюминий
Характеристика элементов III A группы. Бор и алюминий Использование информационно-коммуникационной технологии Игры для Тигры для коррекции общего недоразвития речи в дошкольном возрасте.
Использование информационно-коммуникационной технологии Игры для Тигры для коррекции общего недоразвития речи в дошкольном возрасте. Данные в экономике, их визуализация и предварительная обработка. Визуализация качественных признаков в Microsoft Excel
Данные в экономике, их визуализация и предварительная обработка. Визуализация качественных признаков в Microsoft Excel Бихевиоризм
Бихевиоризм Презентация по ПДД
Презентация по ПДД Пробный ЕГЭ. Вариант 1
Пробный ЕГЭ. Вариант 1 Нуклеиновые кислоты
Нуклеиновые кислоты Презентация по химии Спирты 10 класс
Презентация по химии Спирты 10 класс Секреты ораторского искусства
Секреты ораторского искусства Оперативное управление коммутационными аппаратами
Оперативное управление коммутационными аппаратами Готов ли Ваш ребенок к школе?
Готов ли Ваш ребенок к школе? Внеурочная деятельность в младшей школе как важное условие реализации деятельности ФГОС нового поколения
Внеурочная деятельность в младшей школе как важное условие реализации деятельности ФГОС нового поколения  Расставание с прошлым, дорога в светлое будущее
Расставание с прошлым, дорога в светлое будущее