Содержание
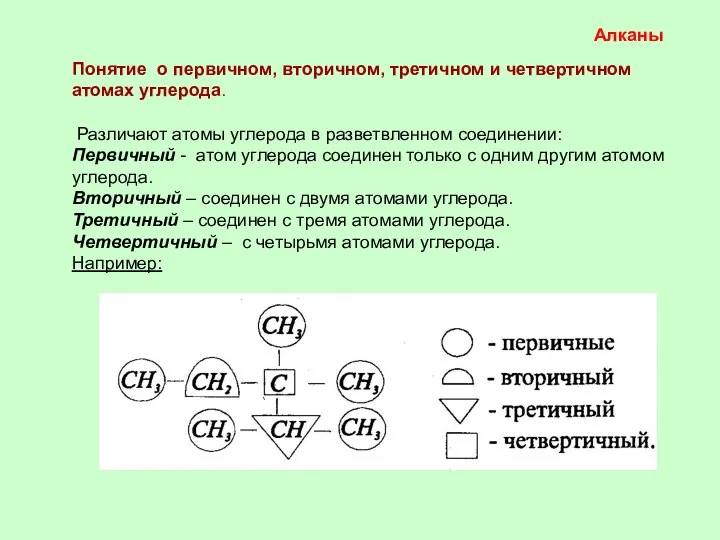
- 2. Алканы Понятие о первичном, вторичном, третичном и четвертичном атомах углерода. Различают атомы углерода в разветвленном соединении:
- 3. | - СН3 - СН2 - - СН – 458 кДж/моль 430 кДж/моль 339 кДж/моль По
- 4. Реакция Вюрца Ш.А. – действие натрия (или цинковой пыли) на галогенпроизводные углеводороды при нагревании. Один из
- 5. Реакция Коновалова М.И. – реакция нитрования алканов или циклоалканов. Замещение водорода на нитрогруппу – NO2 при
- 6. Алкены Правило Марковникова В.В. – присоединение галогеноводородов к несимметричным алкенам – водород галогеноводорода присоединяется к атому
- 7. Правило Зайцева А.М.: атом водорода отщепляется от наименеее гидрогенизированного (с меньшим числом водородных атомом) атома углерода,
- 8. Первый представитель гомологического ряда сопряженных диенов — бутадиен-1,3 — можно получить по реакции, предложенной в 1932
- 9. Реакции галогеналканов со щелочами, их особенности Щелочной гидролиз галогеналканов: 2. Реакция дегидрогалогенирования (- НГ) под действием
- 10. Реакция Вагнера (проба Байера)- окисление алкенов водным раствором перманганата калия с образованием гликолей (двухатомных спиртов): Реакцию
- 12. Скачать презентацию








 Сети электросвязи
Сети электросвязи Становление и развитие реализма как метода и направления. Теоретические споры о реализме
Становление и развитие реализма как метода и направления. Теоретические споры о реализме Театр в Петербурге в 18 веке
Театр в Петербурге в 18 веке Цифровые измерительные приборы (ЦИП)
Цифровые измерительные приборы (ЦИП) УРОК ЗАКРЕПЛЕНИЯ И ОБОБЩЕНИЯ ЗНАНИЙ ПО ТЕМЕ: III-I группы главные подгруппы
УРОК ЗАКРЕПЛЕНИЯ И ОБОБЩЕНИЯ ЗНАНИЙ ПО ТЕМЕ: III-I группы главные подгруппы Презентация по котельным установкам. Типовые компоновки котельных на газомазутном топливе
Презентация по котельным установкам. Типовые компоновки котельных на газомазутном топливе КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Защита информации. Компьютерные вирусы и антивирусные программы
Защита информации. Компьютерные вирусы и антивирусные программы И чувства добрые я лирой пробуждал...
И чувства добрые я лирой пробуждал... Сәулелік зақымдардың қалыптасуы. Организм деңгейінде иондаушы радиацияның әсері. Адамның сәуле ауруы
Сәулелік зақымдардың қалыптасуы. Организм деңгейінде иондаушы радиацияның әсері. Адамның сәуле ауруы Индивидуальный стиль учебной деятельности ученика, как фактор его учебного успеха
Индивидуальный стиль учебной деятельности ученика, как фактор его учебного успеха Квиллинг для начинающих
Квиллинг для начинающих Создание центра сохранения и реабилитации китообразных Черного моря
Создание центра сохранения и реабилитации китообразных Черного моря Моей любимой подруге
Моей любимой подруге Моделирование как средство развития связной речи
Моделирование как средство развития связной речи Мастер – класс Широкая Масленица!. Интерьерный сувенир
Мастер – класс Широкая Масленица!. Интерьерный сувенир Riddles
Riddles К.Д.Ушинский – основоположник русской педагогической науки
К.Д.Ушинский – основоположник русской педагогической науки Эволюция человеческого дома
Эволюция человеческого дома Старинные единицы объёма
Старинные единицы объёма Игра Звуковые человечки Дифференциация звуков З-Ж
Игра Звуковые человечки Дифференциация звуков З-Ж Что такое этикет.
Что такое этикет. Азот
Азот Система отношений компании со стейкхолдерами
Система отношений компании со стейкхолдерами Бессер-Строй. Строительство коттеджей в Уфе и Республике Башкортостан
Бессер-Строй. Строительство коттеджей в Уфе и Республике Башкортостан Механизмы детоксикации
Механизмы детоксикации pril
pril Проектирование системы электроснабжения ТСН Рябина г. Сосновый Бор
Проектирование системы электроснабжения ТСН Рябина г. Сосновый Бор