Содержание
- 2. Прежде чем писать уравнения протекающих реакций, необходимо продумать следующее: определить классы веществ; провести анализ на окислительно
- 3. Даны вещества: : CuSO4 KI Mg H2 SO4 (k) Шаг 1. Определяем классы веществ. соль соль
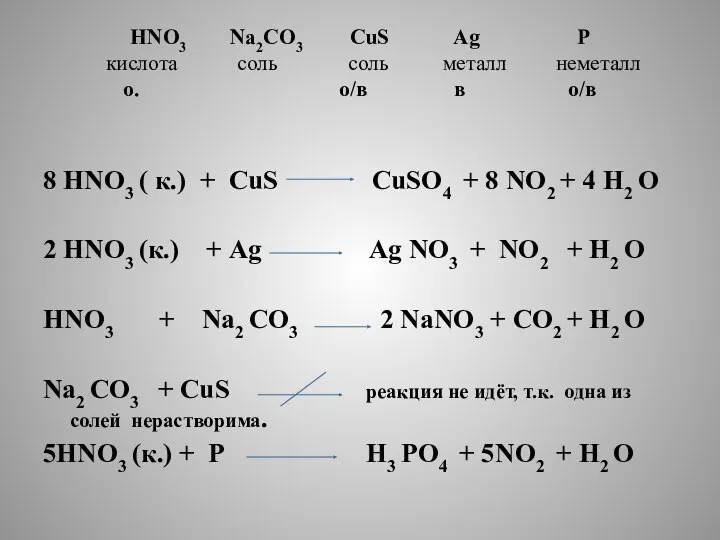
- 4. HNO3 Na2CO3 CuS Ag P кислота соль соль металл неметалл о. о/в в о/в 8 HNO3
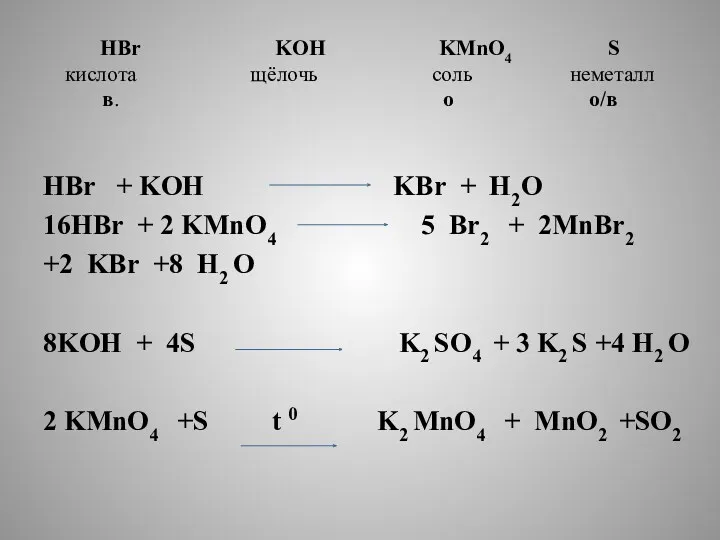
- 5. HBr KOH KMnO4 S кислота щёлочь соль неметалл в. о о/в HBr + KOH KBr +
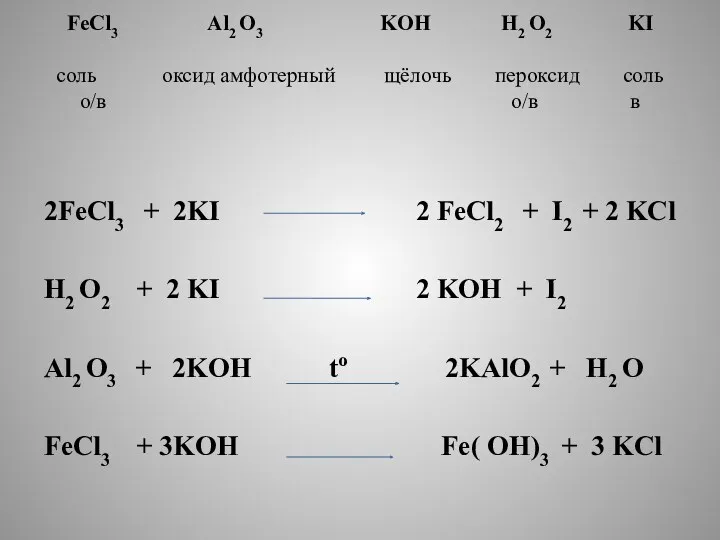
- 6. FeCl3 Al2 O3 KOH H2 O2 KI соль оксид амфотерный щёлочь пероксид соль о/в о/в в
- 7. I2 HNO3 (к.) H2 S O2 неметалл кислота кислота неметалл о/в о в о 10HNO3 (к.)
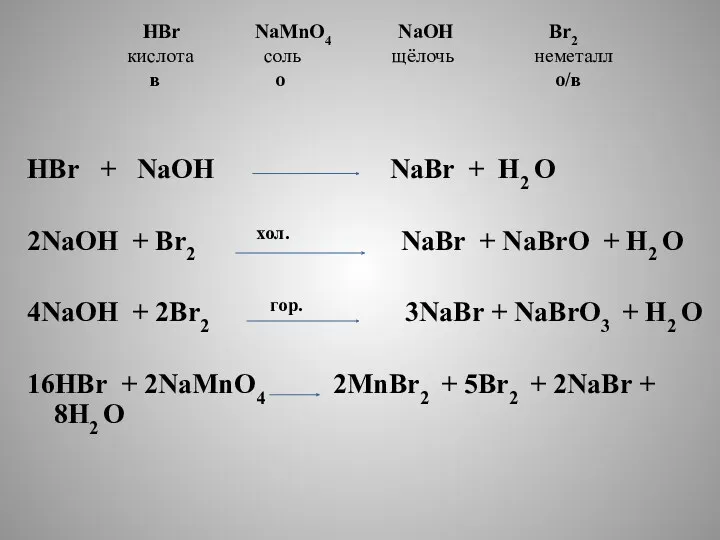
- 8. HBr NaMnO4 NaOH Br2 кислота соль щёлочь неметалл в о о/в HBr + NaOH NaBr +
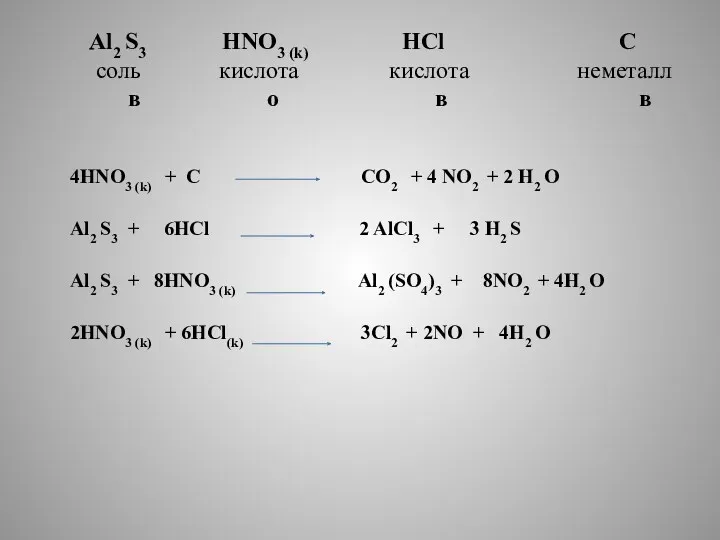
- 9. Al2 S3 HNO3 (k) HCl C соль кислота кислота неметалл в о в в 4HNO3 (k)
- 11. Скачать презентацию



 Старостина
Старостина Презентация к уроку Светская этика 4 класс. Тема: Традиции и обычаи русского народа. Масленица.
Презентация к уроку Светская этика 4 класс. Тема: Традиции и обычаи русского народа. Масленица. игра - викторина По следам войны 1812 года
игра - викторина По следам войны 1812 года Презентация Профилактика ЗРР
Презентация Профилактика ЗРР Логическая структура презентации
Логическая структура презентации Полимерные материалы и изделия
Полимерные материалы и изделия Рождественский сочельник
Рождественский сочельник Математическое моделирование. Форма и принципы представления математических моделей
Математическое моделирование. Форма и принципы представления математических моделей Моя профессия - конструирование и моделирование швейных изделий
Моя профессия - конструирование и моделирование швейных изделий Волейбол. Правила игры
Волейбол. Правила игры Загадки пирамид
Загадки пирамид Пособие для логопедов, воспитателей, родителей Артикуляционная гимнастика
Пособие для логопедов, воспитателей, родителей Артикуляционная гимнастика Строительный генеральный план
Строительный генеральный план Рогожкин Виктор Михайлович
Рогожкин Виктор Михайлович Лакокрасочные матариалы
Лакокрасочные матариалы Проверка электронного документа. Личный кабинет
Проверка электронного документа. Личный кабинет ОАО Газпромнефть — Омский НПЗ
ОАО Газпромнефть — Омский НПЗ 1 сентября во 2 классе.
1 сентября во 2 классе. Презентация Общие химические понятия и законы
Презентация Общие химические понятия и законы Проект по благоустройству территории участка детского сада Лесная поляна
Проект по благоустройству территории участка детского сада Лесная поляна Процессуальное право: административная юрисдикция, конституционное судопроизводство
Процессуальное право: административная юрисдикция, конституционное судопроизводство Возможности использования виртуальной экологической тропы INVITA в работе с родителями воспитанников дошкольного образовательного учреждения
Возможности использования виртуальной экологической тропы INVITA в работе с родителями воспитанников дошкольного образовательного учреждения Автоматизація в легкій промисловості
Автоматизація в легкій промисловості презентация на тему Великая Отечественная война для 3 класса
презентация на тему Великая Отечественная война для 3 класса Безопасность производства газосварочных работ с применением пропан-бутановых смесей
Безопасность производства газосварочных работ с применением пропан-бутановых смесей Основные фонды. Лизинг
Основные фонды. Лизинг Рак предстательной железы
Рак предстательной железы Электротехническая комиссия (IEC) .PPTX
Электротехническая комиссия (IEC) .PPTX