Содержание
- 2. Цели урока Дать план общей характеристики хим. Элемента по его положению в ПСХЭ Повторить строение атома,
- 3. План характеристики ХЭ по его положению в ПСХЭ Адрес ХЭ Строение атома, проявляемые свойства, сравнение с
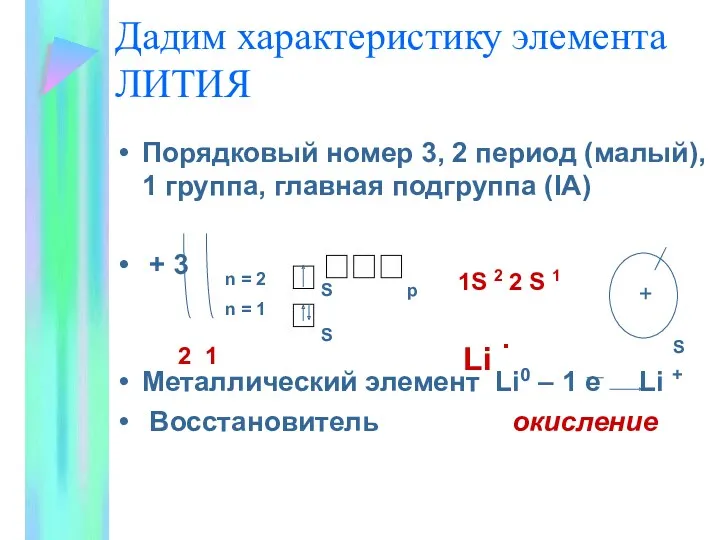
- 4. Дадим характеристику элемента ЛИТИЯ Порядковый номер 3, 2 период (малый), 1 группа, главная подгруппа (IA) +
- 5. Сравним свойства атома лития с соседними ХЭ по группе и периоду В группе : Литий -
- 6. Литий – простое вещество Щелочной металл серебристого цвета, очень легкий, хранится под слоем керосина, не встречается
- 7. Оксид лития – Li2O Солеобразующий, основный Ионная связь (записать схему образования связи) Белый цвет Химические свойства:
- 8. Гидроксид лития - LiOH Li+ - OH- ионная связь Li+ - простой ион, OH- - сложный
- 9. Водородное соединение – LiH гидрид лития Твердый Белый Гигроскопичен Используется как восстановитель Cоли лития Проверить растворимость
- 10. Открытие лития А.Арфведсон, 1817 г. – признал литий новым щелочным металлом Впервые выделен из слоистого силикатного
- 11. Генетический ряд металла Вспомните признаки генетического ряда: Один и тот же химический элемент-металл Разные формы существования
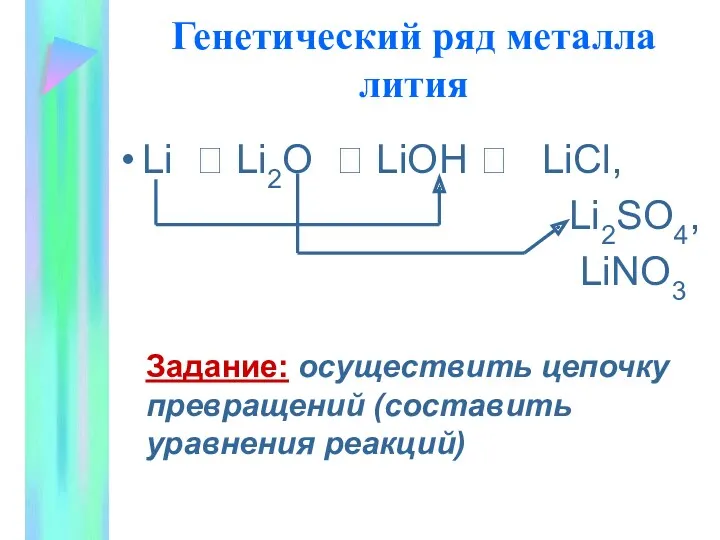
- 12. Генетический ряд металла лития Li ? Li2O ? LiOH ? LiCl, Li2SO4, LiNO3 Задание: осуществить цепочку
- 13. Задачи на примеси и выход продукта реакции Найдите объем углекислого газа (н.у.), который можно получить взаимодействием
- 14. Запомните формулы! η – выход продукта m пр. V пр. η = ----- = ------- m
- 16. Скачать презентацию











 Фразовые глаголы
Фразовые глаголы презентация к уроку по теме тайга 8 класс
презентация к уроку по теме тайга 8 класс Вода в атмосфере
Вода в атмосфере Презентация по алгебре в 10 классе на тему Возрастание и убывание функции.Экстремумы
Презентация по алгебре в 10 классе на тему Возрастание и убывание функции.Экстремумы Сказка как жанр устного народного творчества. Педагогические возможности народной сказки
Сказка как жанр устного народного творчества. Педагогические возможности народной сказки Угарный газ
Угарный газ Промышленный парк Нижнекамск
Промышленный парк Нижнекамск 20231017_teoriya
20231017_teoriya Деревенское подворье: Стиль кантри в ландшафтном дизайне.
Деревенское подворье: Стиль кантри в ландшафтном дизайне. Звёздный час. Внеклассное мероприятие по информатике в 8-х классах
Звёздный час. Внеклассное мероприятие по информатике в 8-х классах Конкурс на государственной гражданской службе
Конкурс на государственной гражданской службе Русская скульптура в XVIII веке
Русская скульптура в XVIII веке Чередующиеся гласные в корне слова
Чередующиеся гласные в корне слова Муфты. Назначение и классификация
Муфты. Назначение и классификация Стоматиты у детей
Стоматиты у детей Современные технологии музыкального воспитания дошкольников
Современные технологии музыкального воспитания дошкольников Классификация машин для земляных работ
Классификация машин для земляных работ poeziya-zhenskoy-dushi--
poeziya-zhenskoy-dushi-- Вимоги до оформлення матеріалів дипломної (або магістерської атестаційної) роботи (відповідно до Державного стандарту України)
Вимоги до оформлення матеріалів дипломної (або магістерської атестаційної) роботи (відповідно до Державного стандарту України) ВЕТЕР.РАБОТА ВЕТРА.
ВЕТЕР.РАБОТА ВЕТРА. Обойные работы. Урок 6 Технология
Обойные работы. Урок 6 Технология Презентация к родительскому собранию Подросток и закон
Презентация к родительскому собранию Подросток и закон Йәшә, сәскә ат, ғәзиз ерем! Диск
Йәшә, сәскә ат, ғәзиз ерем! Диск Армейский чемоданчик
Армейский чемоданчик Гидравлические машины
Гидравлические машины Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Беспилотные летательные аппараты БПЛА
Беспилотные летательные аппараты БПЛА