Содержание
- 2. Цели урока Дать план общей характеристики хим. элемента по его положению в ПСХЭ Повторить строение атома,
- 3. План характеристики ХЭ по его положению в ПСХЭ Адрес ХЭ Строение атома, проявляемые свойства, сравнение с
- 4. Дадим характеристику элемента ФОСФОРА Порядковый номер 15, 3 период (малый), 5 группа, главная подгруппа (VA) +15
- 5. Сравним свойства атома фосфора с соседними ХЭ по группе и периоду В группе : Азот -
- 6. Фосфор – простое вещество Неметалл, имеет разные аллотропные модификации (красный, белый – яд, смерть – 50
- 7. Оксиды фосфора – Р2O3, Р2О5 Солеобразующие, кислотные Ковалентная полярная связь (записать схему образования связи) Белый цвет
- 8. Фосфорная кислота- H3РО4 Н+ - РО43- ковалентная полярная связь Н+ - простой ион, РО43- - сложный
- 9. Водородное соединение – РH3 фосфид водорода (фосфин) Ядовитый, химически активный, бесцветный газ со слабым чесночным запахом,
- 10. Открытие фосфора – «светящийся» открыт гамбургским алхимиком Хеннигом Брандом в 1669 году из человеческой мочи (phosphorus
- 11. Получение фосфора из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600
- 12. Генетический ряд неметалла Вспомните признаки генетического ряда: Один и тот же химический элемент-неметалл Разные формы существования
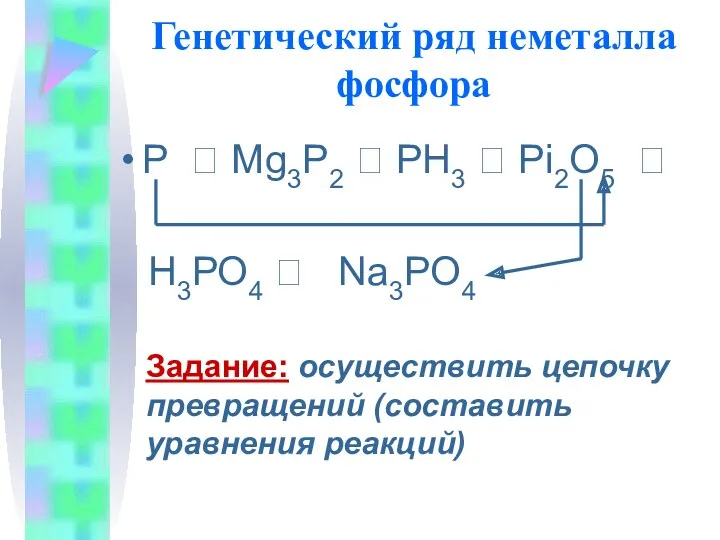
- 13. Генетический ряд неметалла фосфора Р ? Mg3P2 ? PH3 ? Рi2O5 ? H3РО4 ? Na3PO4 Задание:
- 14. Задачи на выход продукта реакции Вычислить выход нитрата аммония (NH4NO3) в % от теоретически возможного, если
- 15. Вспомним формулы! η – выход продукта m пр. V пр. η = ----- = ------- m
- 16. РЕШИТЕ ЗАДАЧИ При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,5
- 17. №1. При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объёмом 4,2 л (н.
- 19. Скачать презентацию















 Физиология высшей нервной деятельности
Физиология высшей нервной деятельности Электростатика. Постоянный ток. Лекция 4
Электростатика. Постоянный ток. Лекция 4 С днем рождения дорогая бабушка
С днем рождения дорогая бабушка Сравнение, сложение и вычитание дробей с разными знаменателями
Сравнение, сложение и вычитание дробей с разными знаменателями Презентация к классному часу 1 сентября
Презентация к классному часу 1 сентября Стандартизация и сертификация
Стандартизация и сертификация Визитка 2 класса А
Визитка 2 класса А Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения
Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения Характеристика детей с различными типами темперамента. Учет свойств темперамента в воспитательно-образовательной работе с дошкольниками как профилактика школьной дезадаптации (презентация)
Характеристика детей с различными типами темперамента. Учет свойств темперамента в воспитательно-образовательной работе с дошкольниками как профилактика школьной дезадаптации (презентация) Религиозные объединения и организации в Российской Федерации
Религиозные объединения и организации в Российской Федерации Организация транспортного процесса перевозки грузов в условиях ООО РусМетСтрой г. Рязань
Организация транспортного процесса перевозки грузов в условиях ООО РусМетСтрой г. Рязань Источники права в Объединенных Арабских Эмиратах
Источники права в Объединенных Арабских Эмиратах презентация к уроку технологии 1 класс
презентация к уроку технологии 1 класс Добренко
Добренко Презентация. Правильные и неправильные дроби. Математика. 5 класс
Презентация. Правильные и неправильные дроби. Математика. 5 класс Презентация Приобщение детей к народному творчеству
Презентация Приобщение детей к народному творчеству Комплексная игровая площадка в микрорайоне Орский городок
Комплексная игровая площадка в микрорайоне Орский городок Влияние алкоголизма на организм человека
Влияние алкоголизма на организм человека Общая фармакология
Общая фармакология Обеспечение качества иммуноферментного анализа
Обеспечение качества иммуноферментного анализа Конструювання нежорсткого дорожнього одягу. Лекція №9
Конструювання нежорсткого дорожнього одягу. Лекція №9 65 лет сельской библиотеке
65 лет сельской библиотеке Многоугольники
Многоугольники B-лимфоциты
B-лимфоциты Технология производства этикеточной продукции
Технология производства этикеточной продукции Факторы производства
Факторы производства Корней Иванович Чуковский. Урок внеклассного чтения. (2 класс)
Корней Иванович Чуковский. Урок внеклассного чтения. (2 класс) Поздравление с Новым 2020 годом
Поздравление с Новым 2020 годом