- Главная
- Без категории
- Характеристика металла Магний

Содержание
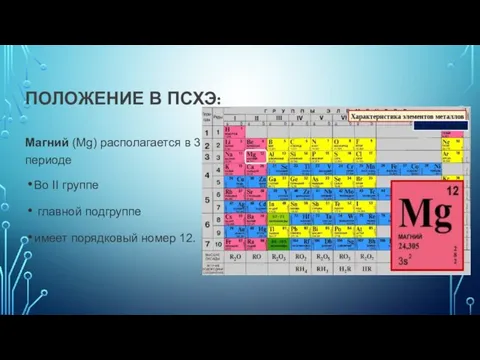
- 2. ПОЛОЖЕНИЕ В ПСХЭ: Магний (Mg) располагается в 3 периоде Во II группе главной подгруппе имеет порядковый
- 3. СТРОЕНИЕ АТОМА МАГНИЯ Магний расположен в третьем периоде, значит, он имеет три оболочки, одна из которых
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА МАГНИЙ — ОЧЕНЬ ЛЕГКИЙ, ДОВОЛЬНО ХРУПКИЙ МЕТАЛЛ, ПОСТЕПЕННО ОКИСЛЯЕТСЯ НА ВОЗДУХЕ, ПРЕВРАЩАЯСЬ В БЕЛЫЙ
- 5. ПОЛУЧЕНИЕ : Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
- 6. ХИМИЧЕСКИЕ СВОЙСТВА МАГНИЯ: 1. Магний — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами: 2.При
- 7. 6.Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния водород: Mg + 2HCl =
- 8. СОЕДИНЕНИЯ МЕТАЛЛА 1)Оксиды: а) С холодной водой оксид магния реагирует очень медленно, но если реакцию проводить
- 10. Скачать презентацию
Слайд 2
ПОЛОЖЕНИЕ В ПСХЭ:
Магний (Mg) располагается в 3 периоде
Во II группе
главной подгруппе
имеет порядковый номер
ПОЛОЖЕНИЕ В ПСХЭ:
Магний (Mg) располагается в 3 периоде
Во II группе
главной подгруппе
имеет порядковый номер
12.
Слайд 3
СТРОЕНИЕ АТОМА МАГНИЯ
Магний расположен в третьем периоде, значит, он имеет три
СТРОЕНИЕ АТОМА МАГНИЯ
Магний расположен в третьем периоде, значит, он имеет три
оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.
Электронную конфигурацию атома магния можно записать двояко:
+12Mg)2)8)2;
1s22s22p63s2.
Атомы магния в соединениях проявляют валентность II.
В соединениях магний проявляет степень окисления +2.
Электронную конфигурацию атома магния можно записать двояко:
+12Mg)2)8)2;
1s22s22p63s2.
Атомы магния в соединениях проявляют валентность II.
В соединениях магний проявляет степень окисления +2.
Слайд 4
ФИЗИЧЕСКИЕ СВОЙСТВА
МАГНИЙ — ОЧЕНЬ ЛЕГКИЙ, ДОВОЛЬНО ХРУПКИЙ МЕТАЛЛ, ПОСТЕПЕННО ОКИСЛЯЕТСЯ НА ВОЗДУХЕ,
ФИЗИЧЕСКИЕ СВОЙСТВА МАГНИЙ — ОЧЕНЬ ЛЕГКИЙ, ДОВОЛЬНО ХРУПКИЙ МЕТАЛЛ, ПОСТЕПЕННО ОКИСЛЯЕТСЯ НА ВОЗДУХЕ,
ПРЕВРАЩАЯСЬ В БЕЛЫЙ ОКСИД МАГНИЯ. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Α-ФОРМЫ CA (УСТОЙЧИВОЙ ПРИ ОБЫЧНОЙ ТЕМПЕРАТУРЕ) ГРАНЕЦЕНТРИРОВАННАЯ КУБИЧЕСКАЯ, А = 5,56Å. АТОМНЫЙ РАДИУС 1,97Å, ИОННЫЙ РАДИУС CA2+, 1,04Å. ПЛОТНОСТЬ 1,74 Г/СМ³(20 °C). ВЫШЕ 464 °C УСТОЙЧИВА ГЕКСАГОНАЛЬНАЯ Β-ФОРМА. TПЛ = 650 °C, TКИП = 1105 °C; ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ ЛИНЕЙНОГО РАСШИРЕНИЯ 22•10-6 (0-300 °C); ТЕПЛОПРОВОДНОСТЬ ПРИ 20 °C 125,6 ВТ/(М•К) ИЛИ 0,3 КАЛ/(СМ•СЕК•°C); УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ (0-100 °C) 623,9 ДЖ/(КГ•К) ИЛИ 0,149 КАЛ/(Г•°C); УДЕЛЬНОЕ ЭЛЕКТРОСОПРОТИВЛЕНИЕ ПРИ 20 °C 4,6•10-8 ОМ•М ИЛИ 4,6•10-6ОМ•СМ; ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ ЭЛЕКТРОСОПРОТИВЛЕНИЯ 4,57•10-3 (20 °C). МОДУЛЬ УПРУГОСТИ 26 ГН/М² (2600 КГС/ММ²); ПРЕДЕЛ ПРОЧНОСТИ ПРИ РАСТЯЖЕНИИ 60 МН/М² (6 КГС/ММ²); ПРЕДЕЛ УПРУГОСТИ 4 МН/М² (0,4 КГС/ММ²), ПРЕДЕЛ ТЕКУЧЕСТИ 38 МН/М² (3,8 КГС/ММ²); ОТНОСИТЕЛЬНОЕ УДЛИНЕНИЕ 50 %; ТВЕРДОСТЬ ПО БРИНЕЛЛЮ 200—300 МН/М² (20-30 КГС/ММ²). МАГНИЙ ДОСТАТОЧНО ВЫСОКОЙ ЧИСТОТЫ ПЛАСТИЧЕН, ХОРОШО ПРЕССУЕТСЯ, ПРОКАТЫВАЕТСЯ И ПОДДАЕТСЯ ОБРАБОТКЕ РЕЗАНИЕМ.
Слайд 5
ПОЛУЧЕНИЕ :
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
ПОЛУЧЕНИЕ :
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2–(эл.ток)à Mg + Cl2 или восстановлением прокаленного доломита в электропечах при 1200–1300°С: 2(CaO · MgO) + Si = 2Mg + Ca2SiO4. Кальций: минералы доломит CaCO3·MgCO3, кальцит CaCO3, гипс CaSO4 · 2H2O.
Слайд 6
ХИМИЧЕСКИЕ СВОЙСТВА МАГНИЯ:
1. Магний — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
2.При
ХИМИЧЕСКИЕ СВОЙСТВА МАГНИЯ:
1. Магний — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
2.При
нагревании магний взаимодействует с галогенами с образованием галогенидов; при 500–600 oC при взаимодействии с серой образуется MgS; при более высокой температуре возможно образование карбидов MgC2 и Mg2C3, силицидов MgSi и Mg3Si2, фосфида Mg3P2. Нормальный электродный потенциал магния в кислой среде составляет -2,37 в, в щелочной -2,69 в. Магний – сильный восстановитель, может вытеснить большинство металлов из их солей, H2 из воды и кислот.
3.В результате взаимодействия магния с кислородом образуется окись магния MgO, которая имеет кристаллическую структуру типа NaCl. Эта структура характеризуется сильной гетерополярной связью. Теплота образования реакции равна 146,1 ккал/моль. He удивительно, что при такой высокой энергии образования отсутствует растворимость кислорода в магнии.
4.При взаимодействии серы с металлами, например с магнием, образуется сульфид магния.
5.Реакция магния с водой протекает при обычных условиях. Mg + 2H2O → Mg(OH)2 + H2.
3.В результате взаимодействия магния с кислородом образуется окись магния MgO, которая имеет кристаллическую структуру типа NaCl. Эта структура характеризуется сильной гетерополярной связью. Теплота образования реакции равна 146,1 ккал/моль. He удивительно, что при такой высокой энергии образования отсутствует растворимость кислорода в магнии.
4.При взаимодействии серы с металлами, например с магнием, образуется сульфид магния.
5.Реакция магния с водой протекает при обычных условиях. Mg + 2H2O → Mg(OH)2 + H2.
Слайд 7
6.Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния водород: Mg + 2HCl = MgCl2
6.Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния водород: Mg + 2HCl = MgCl2
+ H2 ↑
6.1Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду: 4Mg + 10HNO3= 4Mg(NO3)2 + 2N2O↑ + 5H2O
6.2 В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород: Mg + H2S = MgS + H2
7.2Химические свойства солей магния. Большинство солей Магния хорошо растворимо в воде, например сульфат магния 2MgSO4 + 2H2O = (MgOH)2SO4 + H2SO4 мало растворимы MgF2, MgCО3, Mg3(PO4)2 и некоторые двойные соли. MgSO4+H2O=MgO+H2SO4 Комплексные соединения магния малоустойчивы и образуются обычно только в щелочной среде.
8.Магниетермия – это восстановление металлов из оксидов магнием. CuO + Mg = Cu + MgO.
6.1Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду: 4Mg + 10HNO3= 4Mg(NO3)2 + 2N2O↑ + 5H2O
6.2 В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород: Mg + H2S = MgS + H2
7.2Химические свойства солей магния. Большинство солей Магния хорошо растворимо в воде, например сульфат магния 2MgSO4 + 2H2O = (MgOH)2SO4 + H2SO4 мало растворимы MgF2, MgCО3, Mg3(PO4)2 и некоторые двойные соли. MgSO4+H2O=MgO+H2SO4 Комплексные соединения магния малоустойчивы и образуются обычно только в щелочной среде.
8.Магниетермия – это восстановление металлов из оксидов магнием. CuO + Mg = Cu + MgO.
Слайд 8
СОЕДИНЕНИЯ МЕТАЛЛА
1)Оксиды:
а) С холодной водой оксид магния реагирует очень медленно, но
СОЕДИНЕНИЯ МЕТАЛЛА
1)Оксиды:
а) С холодной водой оксид магния реагирует очень медленно, но
если реакцию проводить с водяным паром, реакция пойдет быстрее.
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
б) Растворение в кислотах: MgO + HCl (разб) → MgCl₂ + H₂O (для протекания реакции нужны неконцентрированные кислоты)
MgO + H₂SO₄ → MgSO₄ + H₂O
В реакциях с кислотами MgO показывает общие войства окссидов (образуя соль и воду).
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
б) Растворение в кислотах: MgO + HCl (разб) → MgCl₂ + H₂O (для протекания реакции нужны неконцентрированные кислоты)
MgO + H₂SO₄ → MgSO₄ + H₂O
В реакциях с кислотами MgO показывает общие войства окссидов (образуя соль и воду).






 МИНСТРОЙ АО. О реализации мероприятия Социальная ипотека
МИНСТРОЙ АО. О реализации мероприятия Социальная ипотека Одяг і взуття. Більшеньким
Одяг і взуття. Більшеньким Управление изменениями и жизненным циклом организации
Управление изменениями и жизненным циклом организации Автономные системы навигации летательных аппаратов
Автономные системы навигации летательных аппаратов Табличная обработка информации на компьютере. Электронные таблицы MS Excel. Лекция № 10
Табличная обработка информации на компьютере. Электронные таблицы MS Excel. Лекция № 10 Учимся играя.
Учимся играя. Нәресте дамуының туа біткен ақаулықтарының профилактикасы және ерте диагностикасы
Нәресте дамуының туа біткен ақаулықтарының профилактикасы және ерте диагностикасы Сложное дополнение
Сложное дополнение Обычаи народов России
Обычаи народов России Организация предметно-развивающей среды в сенсомоторном развитии детей младшего возраста.
Организация предметно-развивающей среды в сенсомоторном развитии детей младшего возраста. Жизнь дана на добрые дела
Жизнь дана на добрые дела Классификации.
Классификации. Экспертиза качества сыра Российский разных производителей
Экспертиза качества сыра Российский разных производителей Риджионализм. Период наибольшего расцвета
Риджионализм. Период наибольшего расцвета Задержка мочеиспускания
Задержка мочеиспускания Нетрадиционные источники энергии
Нетрадиционные источники энергии Семилетняя война 1756-1763
Семилетняя война 1756-1763 Презентации к урокам в 1 классе Диск Диск Диск Диск
Презентации к урокам в 1 классе Диск Диск Диск Диск Dream house
Dream house Письменное умножение на двузначное число
Письменное умножение на двузначное число Чамзинка. Герои района.
Чамзинка. Герои района. Развивающая среда в группе детей третьего года жизни
Развивающая среда в группе детей третьего года жизни Итоговое сочинение по литературе
Итоговое сочинение по литературе Терроризм и опасность вовлечения подростка в террористическую деятельность
Терроризм и опасность вовлечения подростка в террористическую деятельность Информационная безопасность. Решения DEPO Security Systems
Информационная безопасность. Решения DEPO Security Systems Как растет цветок
Как растет цветок Устройства ввода и вывода информации
Устройства ввода и вывода информации Проектный метод в деятельности дошкольного учреждения
Проектный метод в деятельности дошкольного учреждения