Содержание
- 2. Основные понятия Кинетика – наука о скоростях и механизмах процессов Химическая кинетика изучает скорости и механизмы
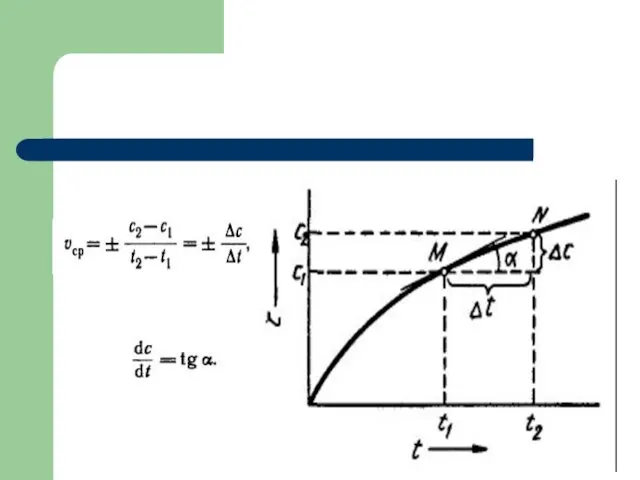
- 3. Скорость химической реакции Под скоростью химической реакции понимается число элементарных актов взаимодействия реагентов в единицу времени
- 4. Скорость химической реакции На практике скорость химической реакции выражается изменением концентрации реагентов или продуктов в единицу
- 8. Классификация химических реакций а) Гомогенные- реакции в которых реагенты находятся в одном агрегатном состоянии б) Гетерогенные-
- 9. ВЛИЯНИЕ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ НА СКОРОСТЬ РЕАКЦИЙ В
- 10. Классификация химических реакций
- 11. Простые химические реакции Простая или элементарная реакция протекает в одну стадию, без образования промежуточных веществ. Простые
- 13. Мономолекулярная реакция – в элементарном акте участвует одна молекула (разложение)
- 14. Бимолекулярная реакция - в элементарном акте участвуют 2 молекулы (столкновение двух молекул)
- 15. Трехмолекулярная реакция в элементарном акте участвуют три молекулы, вероятность их столкновения мала
- 16. Сложные реакции Сложные реакции протекают в несколько стадий с образованием промежуточных продуктов. Сложные реакции бывают: последовательные
- 17. Последовательные реакции
- 18. Параллельные реакции
- 19. Цепные реакции
- 20. Закон действующих масс (Гульдберг и Вааге) Скорость химической реакции пропорциональна концентрации реагирующих веществ.
- 21. Где: СА, СВ – молярные концентрации реагентов в любой момент времени моль/л, k – константа скорости
- 22. ПРИМЕР: по N2O первый порядок, по Н2 первый порядок, суммарный - второй. Для простой реакции общий
- 23. Порядок реакции Если реакция сложная, то происходит ряд промежуточных превращений и порядок реакции равен порядку реакции
- 24. ПРИМЕР: Реакция образования воды, сложная цепная реакция: 2Н2 + О2 = 2Н2О Н2 + О2 =
- 25. ПРИМЕР: порядок по водороду - 0,4 порядок по кислороду – 0,3 сумма равна 0,7 порядок реакции
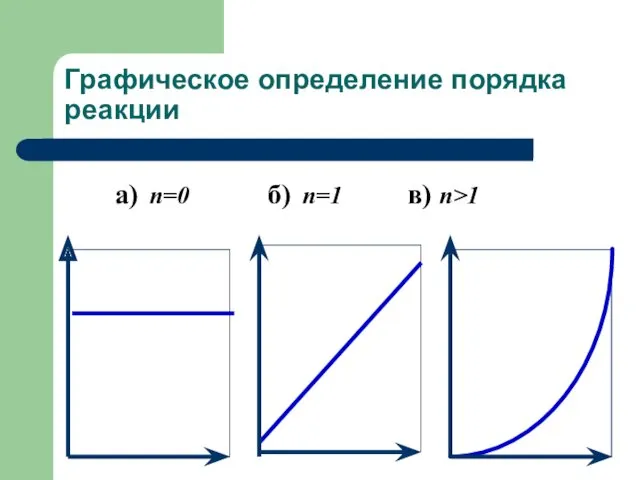
- 26. Графическое определение порядка реакции в координатах (C; t) Если построить зависимость в координатах концентрация от времени,
- 27. Графическое определение порядка реакции а) n=0 б) n=1 в) n>1
- 28. Влияние температуры на скорость химической реакции Чем выше температура, тем больше скорость химической реакции. Почему? При
- 29. Влияние температуры на скорость химической реакции Осуществить синтез воды 2Н2 + О2 = 2Н2О, при t
- 30. Влияние температуры на скорость химической реакции Правило Вант-Гоффа: При увеличении температуры на каждые 100 скорость химической
- 31. Температурный коэффициент γ – температурный коэффициент Вант-Гоффа, показывает во сколько раз возросла скорость химической реакции. Где
- 32. Пример: Во сколько раз увеличится скорость химической реакции при повышении Т от 200 до 500 ºС,
- 33. Решение:
- 34. Пример: При 100 ºС реакция идет за 16 минут , сколько времени надо при 140 ºС,
- 35. Решение:
- 36. Теория активации Увеличение скорости реакции с повышением температуры значительно больше, чем увеличение скорости движения молекул. Разъясняет
- 37. Теория активации Во взаимодействие вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества.
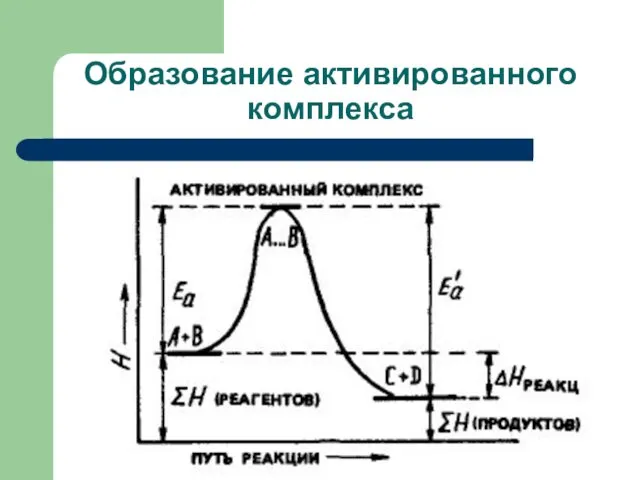
- 38. Энергия активации Энергия, которую надо придать молекулам реагирующих веществ, для того, чтобы сделать их активными, называется
- 39. Важно! Энергия активации характеристика реакции в целом, а не для вещества. Энергия активации - это наименьшая
- 40. Реакция начинается только между теми частицами, которые обладают повышенной энергией. Такие частицы при столкновении сначала образуют
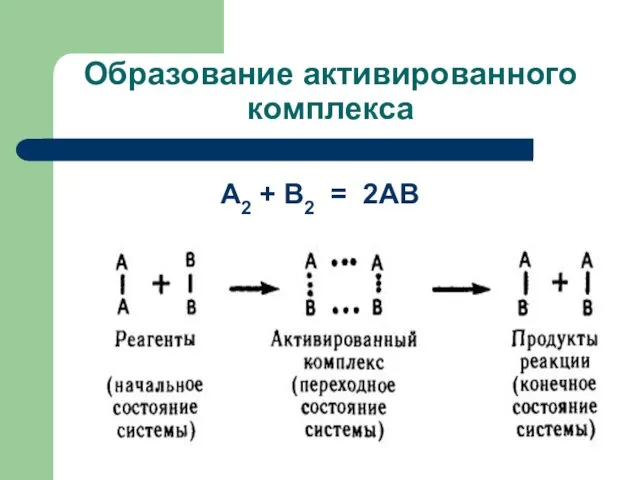
- 41. Образование активированного комплекса А2 + В2 = 2АВ
- 42. Пример: Н2 + J2 = 2HJ Электронные облака не дают взаимодействовать молекулам, избыточная энергия нужна для
- 43. Образование активированного комплекса
- 44. Образование активированного комплекса В активированном комплексе происходит перераспределение электронной плотности между атомами: связи А-В начинают образовываться
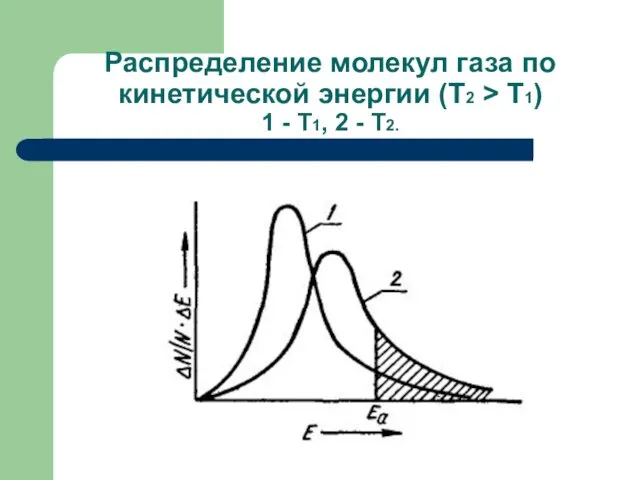
- 45. Распределение молекул газа по кинетической энергии (Т2 > Т1) 1 - Т1, 2 - Т2.
- 46. Уравнение Аррениуса К – константа скорости реакции, е – основание натурального логарифма, Т – температура, в
- 47. Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна
- 48. Графический метод определения энергии активации Строят график в аррениусовских координатах (ln k – 1/T) ln k
- 49. Скорость химической реакции в значительной мере зависит от энергии активации. Для подавляющего большинства реакций она лежит
- 50. Пример: Энергия активации некоторой реакции при 500 К равна 80 кДж/моль. Определить долю активных молекул. Решение:
- 51. Влияние давления на скорость химической реакции Если в реакции участвуют газообразные вещества, то повышение давления равносильно
- 52. ↑ давления → ↑ конц-ции газа → ↑ v х.р. ↓ давления → ↓ конц-ции газа
- 53. Пример: 2NOгаз + 2H2газ → N2 + 2H2O Как изменится скорость химической реакции при увеличении давления
- 54. Решение: 2NOгаз + 2H2газ → N2 + 2H2O 1) V1 = k · РNO2 · РH22
- 55. КАТАЛИЗ
- 56. Катализ - это один из наиболее распространенных в химической практике методов ускорения химических реакций
- 57. Катализаторы – это вещества, которые ускоряют химические реакции за счет участия в образовании промежуточных соединений, в
- 58. В присутствии катализатора возникают другие активированные комплексы. Для их образования требуется меньше энергии, чем для образования
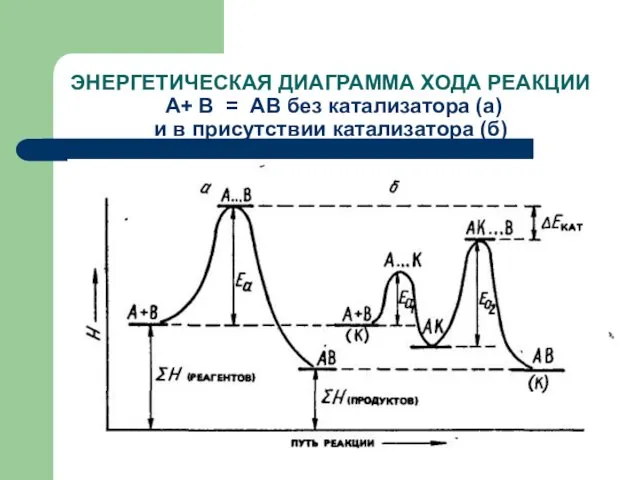
- 59. ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА ХОДА РЕАКЦИИ А+ В = АВ без катализатора (а) и в присутствии катализатора (б)
- 60. Т. о., в присутствии катализаторов энергия активации реакции понижается. Уменьшение энергии активации приводит к увеличению скорости
- 61. Пример Платина снижает значение Еа реакции Н2 + J2 = 2HJ от Еа =198 кДж/моль до
- 62. Пример Влияние катализатора на снижение энергии активации процесса Еа можно показать на следующих данных для реакции
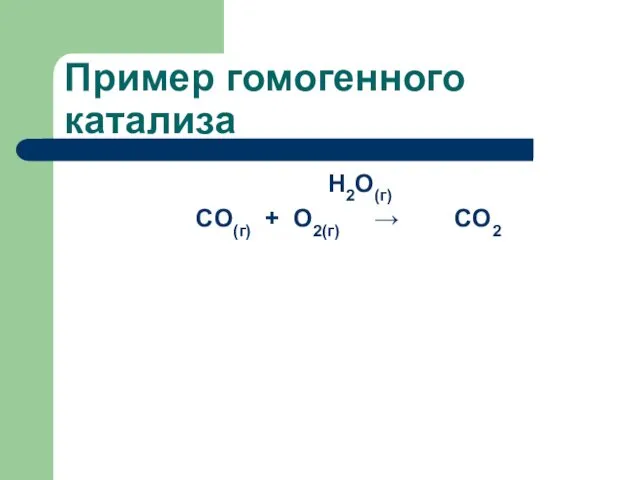
- 64. Пример гомогенного катализа
- 65. Пример гомогенного катализа H2O(г) CO(г) + О2(г) → CO2
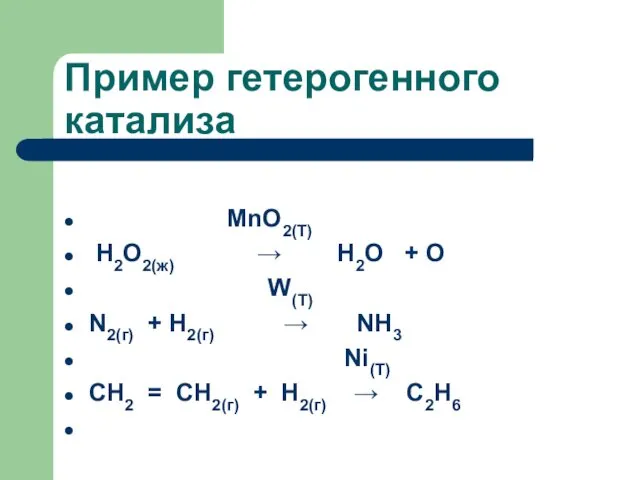
- 66. Пример гетерогенного катализа
- 67. Пример гетерогенного катализа MnO2(T) Н2О2(ж) → Н2О + О W(T) N2(г) + H2(г) → NH3 Ni(T)
- 68. Эффективность гетерогенных катализаторов обычно намного больше чем гомогенных. Скорость реакций в случае гомогенного катализатора зависит от
- 69. Сорбция - поглощение газа или жидкого вещества твердым веществом - сорбентом.
- 70. Различают: Адсорбция – поглощение поверхностью Абсорбция – поглощение всем объемом, поглощение газа жидкостью, или твердым веществом.
- 71. Пример Энергия активации некоторой реакции в отсутствии катализатора равна 75,24 кДж/моль, а с катализатором – 50,14
- 72. Выводы: 1. Скорость химической реакции зависит от температуры, концентрации реагирующих веществ, их природы и наличия катализатора.
- 74. Скачать презентацию































































 Основы квантовой физики. Волновые свойства микрочастиц
Основы квантовой физики. Волновые свойства микрочастиц ОС Школа 2100 Урок технологии 1 класс
ОС Школа 2100 Урок технологии 1 класс Новые проекты Санкт-Петербурга
Новые проекты Санкт-Петербурга Презентация Развитие фонематического восприятия старших дошкольников посредством дидактических игр
Презентация Развитие фонематического восприятия старших дошкольников посредством дидактических игр День птиц
День птиц 20231028_chitatelskaya_gramotnost
20231028_chitatelskaya_gramotnost Технология междурядной обработки картофеля
Технология междурядной обработки картофеля Прохоров Евгений Павлович - Социолог, филолог, создатель советской и современной российской теорий журналистики
Прохоров Евгений Павлович - Социолог, филолог, создатель советской и современной российской теорий журналистики Младший школьный возраст
Младший школьный возраст Презентация: Водный мир нашей области
Презентация: Водный мир нашей области Алексей Гаврилович Венецианов (1780-1847)
Алексей Гаврилович Венецианов (1780-1847) Морфологические нормы_тест_для студентов
Морфологические нормы_тест_для студентов Адаптация студентов к обучению в медицинском вузе
Адаптация студентов к обучению в медицинском вузе Цвет. Основы цветоведения
Цвет. Основы цветоведения Презентация к сценарию выпускного вечера в начальной школе
Презентация к сценарию выпускного вечера в начальной школе Электронные деньги. Общее представление
Электронные деньги. Общее представление Озоновый слой
Озоновый слой Физиология сердечно – сосудистой системы
Физиология сердечно – сосудистой системы Tag Questions
Tag Questions Анатомо-физиологические особенности несовершеннолетних и их физического развития. Нормативные документы по физической культуре
Анатомо-физиологические особенности несовершеннолетних и их физического развития. Нормативные документы по физической культуре Русь при Владимире I Крестителе
Русь при Владимире I Крестителе Нефть. Свойства нефти
Нефть. Свойства нефти Адкуль пайшлі назвы беларускіх гарадоў - Гомеля, Брэста, Гродна
Адкуль пайшлі назвы беларускіх гарадоў - Гомеля, Брэста, Гродна Заповедный сад
Заповедный сад Развивающая предметно-пространственная среда( ФГОС) группа Улыбка Леснополянская НШ
Развивающая предметно-пространственная среда( ФГОС) группа Улыбка Леснополянская НШ Эксплуатация баллонов, предназначенных для сжатых, сжиженных и растворенных под давлением газов
Эксплуатация баллонов, предназначенных для сжатых, сжиженных и растворенных под давлением газов История села Чирово
История села Чирово Противогрибковые и антигельминтные средства
Противогрибковые и антигельминтные средства