Содержание
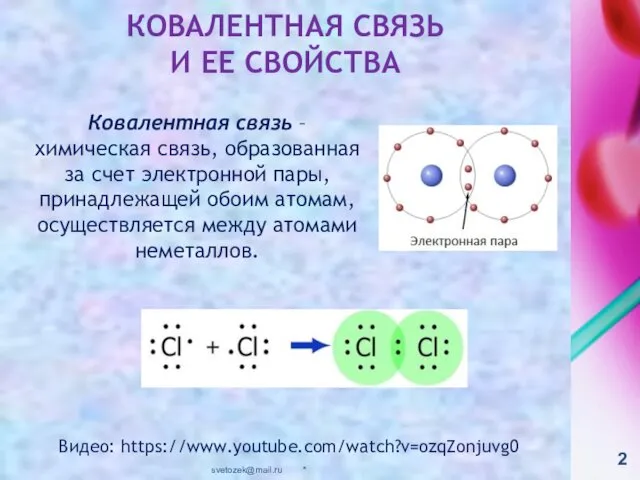
- 2. КОВАЛЕНТНАЯ СВЯЗЬ И ЕЕ СВОЙСТВА Ковалентная связь – химическая связь, образованная за счет электронной пары, принадлежащей
- 3. 1. Насыщаемость Способность атомов образовывать ограниченное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав:
- 4. 3. Полярность Если ковалентная связь образована одинаковыми атомами, то такая связь называется ковалентной неполярной. Если же
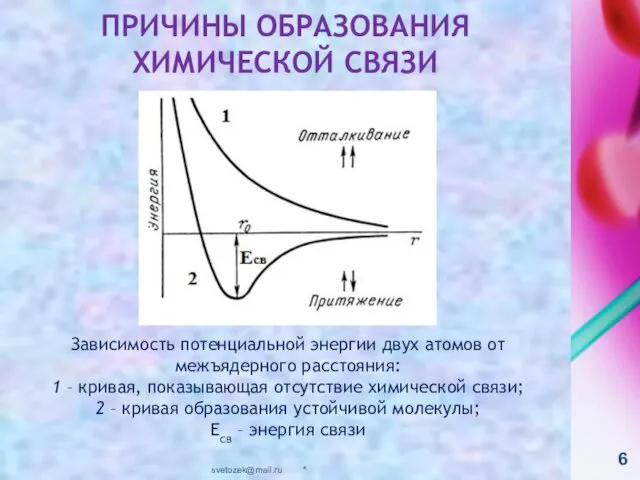
- 5. ПРИЧИНЫ ОБРАЗОВАНИЯ ХИМИЧЕСКОЙ СВЯЗИ Основная причина образования химической связи – появление между атомами одной или нескольких
- 6. * svetozek@mail.ru ПРИЧИНЫ ОБРАЗОВАНИЯ ХИМИЧЕСКОЙ СВЯЗИ Зависимость потенциальной энергии двух атомов от межъядерного расстояния: 1 –
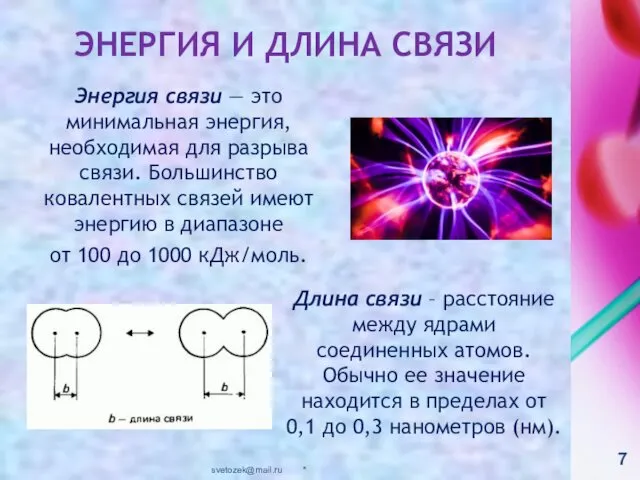
- 7. ЭНЕРГИЯ И ДЛИНА СВЯЗИ Энергия связи — это минимальная энергия, необходимая для разрыва связи. Большинство ковалентных
- 8. Существует два вида механизмов образования ковалентной связи: обменный; донорно-акцепторный. * svetozek@mail.ru МЕХАНИЗМ И СПОСОБЫ ОБРАЗОВАНИЯ СВЯЗИ
- 9. При обменном механизме электронная пара образуется за счет неспаренных электронов (перекрывания одноэлектронных облаков). Важно отметить, что
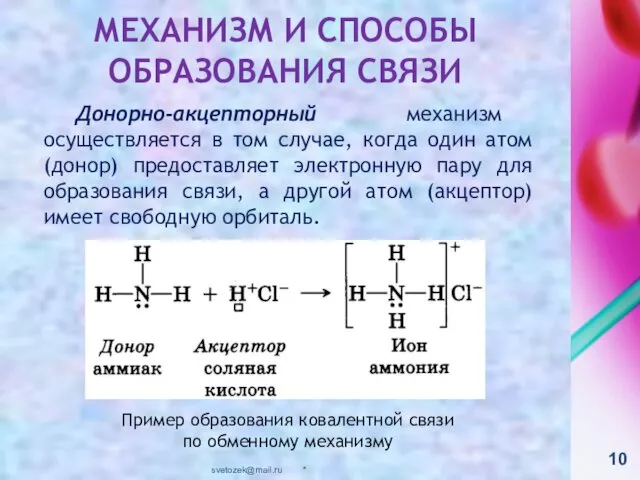
- 10. Донорно-акцепторный механизм осуществляется в том случае, когда один атом (донор) предоставляет электронную пару для образования связи,
- 11. ВАЛЕНТНОСТЬ Способность атомов химических элементов образовывать определённое количество химических связей. Правила определения валентности элементов в соединениях
- 12. 5. Металлы, находящиеся в подгруппах, имеют валентность, равную номеру группы. 6. Неметаллы в основном проявляют высшую
- 13. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ Метод, описывающий образование ковалентных связей в молекулах, базируется на следующих положениях. 1. Химическая
- 14. ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ И ТИПЫ ГИБРИДНЫХ ОРБИТАЛЕЙ В результате гибридизации образуются новые гибридные орбитали, которые ориентируются в
- 15. Известно пять типов орбиталей: s, p, d, f и g. Атом каждого элемента имеет все типы
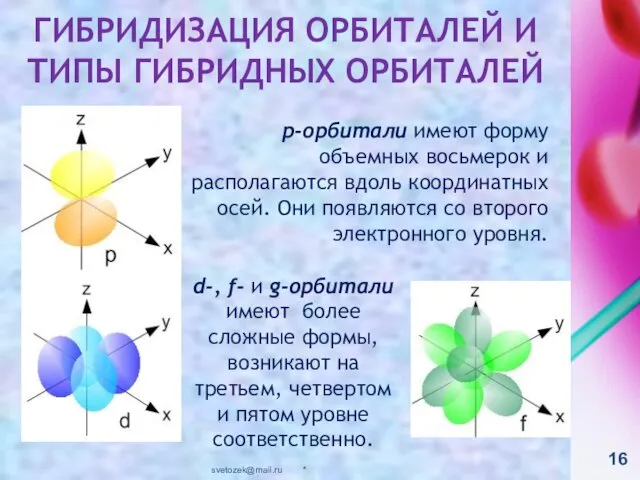
- 16. * svetozek@mail.ru ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ И ТИПЫ ГИБРИДНЫХ ОРБИТАЛЕЙ р-орбитали имеют форму объемных восьмерок и располагаются вдоль
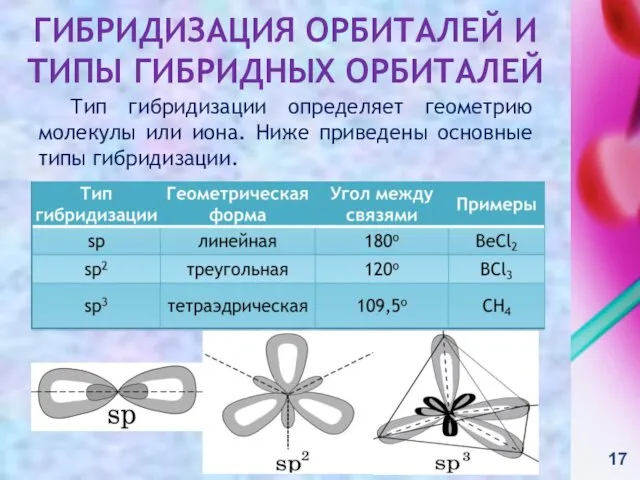
- 17. Тип гибридизации определяет геометрию молекулы или иона. Ниже приведены основные типы гибридизации. * ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ И
- 18. ИОННАЯ СВЯЗЬ Химическая связь, образованная за счет электростатического притяжения между катионами и анионами. Пример: реакция между
- 19. Химическая связь, образованная за счет притяжения катионов и электронов, находящихся в кристаллической решетке металла. Характерна для
- 20. ПРОМЕЖУТОЧНЫЕ ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ Химическая связь, включающая в себя свойства двух видов связи. Пример: связь в
- 21. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ Условный заряд, который получает атом в результате отдачи или принятия электронов,
- 22. 1. СО металлов в соединениях всегда положительные. 2. Высшая СО соответствует номеру группы периодической системы. Исключение
- 23. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ Взаимодействие, не приводящее к разрыву или созданию химических связей. Существует три типа такого взаимодействия.
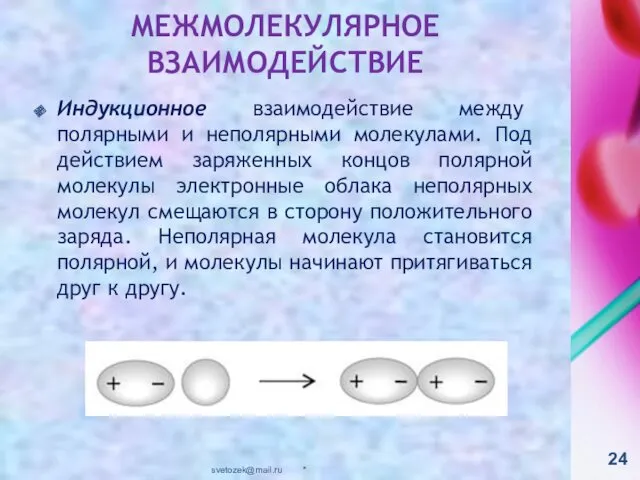
- 24. Индукционное взаимодействие между полярными и неполярными молекулами. Под действием заряженных концов полярной молекулы электронные облака неполярных
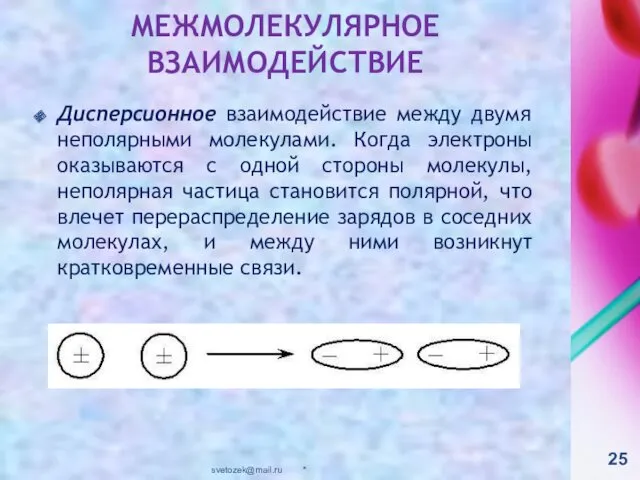
- 25. Дисперсионное взаимодействие между двумя неполярными молекулами. Когда электроны оказываются с одной стороны молекулы, неполярная частица становится
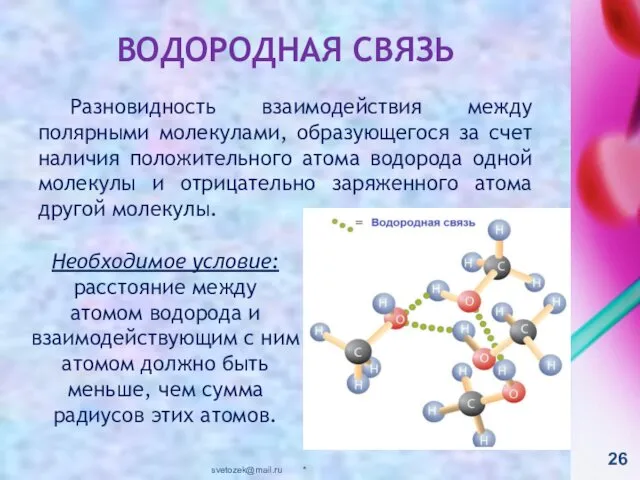
- 26. ВОДОРОДНАЯ СВЯЗЬ Разновидность взаимодействия между полярными молекулами, образующегося за счет наличия положительного атома водорода одной молекулы
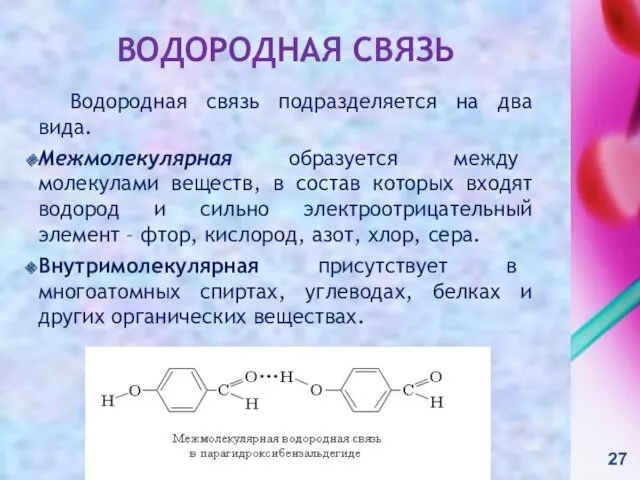
- 27. ВОДОРОДНАЯ СВЯЗЬ Водородная связь подразделяется на два вида. Межмолекулярная образуется между молекулами веществ, в состав которых
- 28. ВАН-ДЕР-ВААЛЬСОВА СВЯЗЬ Химическая связь между атомами или молекулами, образующаяся за счет ван-дер-ваальсовых сил. Различают 3 вида
- 29. ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА Бердетт Дж. Химическая связь / Дж. Бердетт: пер. с англ. – М.: Мир, 2008.
- 31. Скачать презентацию


















 Условия развития культуры второй половины XIX века
Условия развития культуры второй половины XIX века Лев Николаевич Толстой
Лев Николаевич Толстой Разработка и обоснование нового туристского маршрута: Тверская область, Торжок
Разработка и обоснование нового туристского маршрута: Тверская область, Торжок Опыт работы по гендерному воспитанию Мальчики и девочки два разных мира
Опыт работы по гендерному воспитанию Мальчики и девочки два разных мира Эскизный альбом для проведения экспертизы на земельный участок, расположенный по адресу: ул. Шипиловская, вл. 58 (ЮАО)
Эскизный альбом для проведения экспертизы на земельный участок, расположенный по адресу: ул. Шипиловская, вл. 58 (ЮАО) Cowon D2 Service Manual
Cowon D2 Service Manual Астана қаласы
Астана қаласы АДАПТАЦИЯ ОРГАНИЗМА ЧЕЛОВЕКА К ФАКТОРАМ СРЕДЫ.
АДАПТАЦИЯ ОРГАНИЗМА ЧЕЛОВЕКА К ФАКТОРАМ СРЕДЫ. Российское движение школьников
Российское движение школьников Нарушения обмена хромопротеидов
Нарушения обмена хромопротеидов Применение Вооруженных Сил Российской Федерации в борьбе с терроризмом
Применение Вооруженных Сил Российской Федерации в борьбе с терроризмом Социальная политика государства и управление социальным развитием организации (Россия и Сингапур)
Социальная политика государства и управление социальным развитием организации (Россия и Сингапур) Неделя предметов развивающего цикла
Неделя предметов развивающего цикла Классный час Что делать, если ... тебя дразнят ребята
Классный час Что делать, если ... тебя дразнят ребята 1 сентября Ведущие дети. По ходу праздника звучат минусовки школьных детских песен. Слайд 1: Звучит клип Пора в школу , дети проходят и усаживаются на свои места. Слайд 2: Слайд 3: Вед. Сегодня у нас радостный праздник - первый школьны
1 сентября Ведущие дети. По ходу праздника звучат минусовки школьных детских песен. Слайд 1: Звучит клип Пора в школу , дети проходят и усаживаются на свои места. Слайд 2: Слайд 3: Вед. Сегодня у нас радостный праздник - первый школьны Инженерный анализ методом конечных элементов. Оптимизация конструкций
Инженерный анализ методом конечных элементов. Оптимизация конструкций Географические исследования на территории Казахстана
Географические исследования на территории Казахстана Современные синтетические материалы в хирургии и травматологии
Современные синтетические материалы в хирургии и травматологии О самых дорогих словах - презентация к внеклассному занятию.
О самых дорогих словах - презентация к внеклассному занятию. Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения
Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения Правовые основы взаимоотношения полов
Правовые основы взаимоотношения полов Игра как активная форма развития воображения у детей дошкольного возраста
Игра как активная форма развития воображения у детей дошкольного возраста Понятие системы экономики качества
Понятие системы экономики качества Предпосылки петровских преобразований
Предпосылки петровских преобразований Особливості організації навчально-виховного процесу на уроках математики
Особливості організації навчально-виховного процесу на уроках математики Инженерное оборудование зданий
Инженерное оборудование зданий Математика 5 класс. Вариант 3
Математика 5 класс. Вариант 3 презентация стихотворения Весна Г.Тукая
презентация стихотворения Весна Г.Тукая