Содержание
- 2. Термодинамической системой называется объект природы, состоящий из большого числа молекул и отделенный от других объектов природы
- 3. Если отсутствует теплообмен системы с внешней средой, запас ее внутренней энергии остается постоянным. Сообщенная системе теплота
- 4. Введем новую функцию состояния: H = U + pV, которая больше внутренней энергии на величину работы
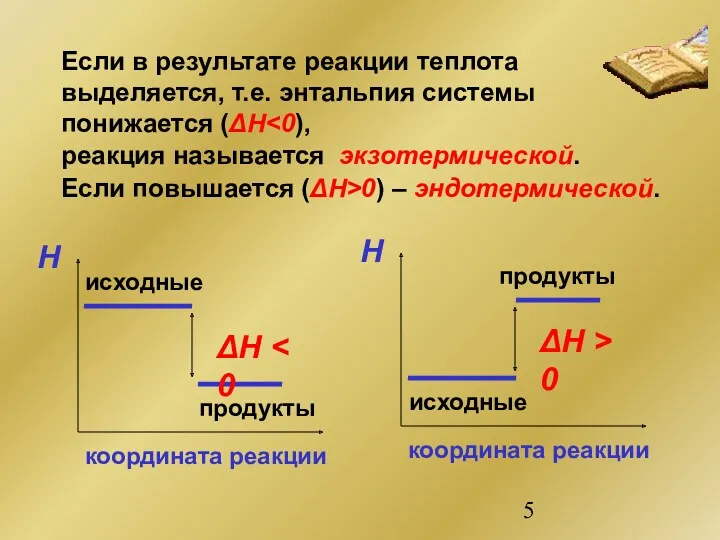
- 5. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (ΔH реакция называется экзотермической. Если повышается
- 6. Второй закон термодинамики Любая система, предоставленная сама себе, в среднем будет изменяться в направлении состояния, отвечающего
- 7. ΔS = Q/Т Энтропия (ΔS) – функция, приращение которой равно теплоте Q, подведенной к системе в
- 8. Если в процессе степень беспорядка не изменяется (ΔS = 0), то направление процесса определяется изменением энтальпии,
- 9. Дж. Гиббс (1839-1903) В качестве критерия самопроизвольности процессов целесообразно ввести новую функцию состояния, которая учитывает влияние
- 10. Второе начало термодинамики (определение Гиббса) В изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы,
- 11. Факторы, определяющие ход процесса ΔG = ΔH - TΔS
- 12. aA + bB + cC + … → Закон действующих масс Кинетика – наука о механизмах
- 13. Н.Н. Бекетов (1826-1911) Константа скорости реакции равна скорости реакции при концентрациях веществ, равных 1 моль/л. Показатели
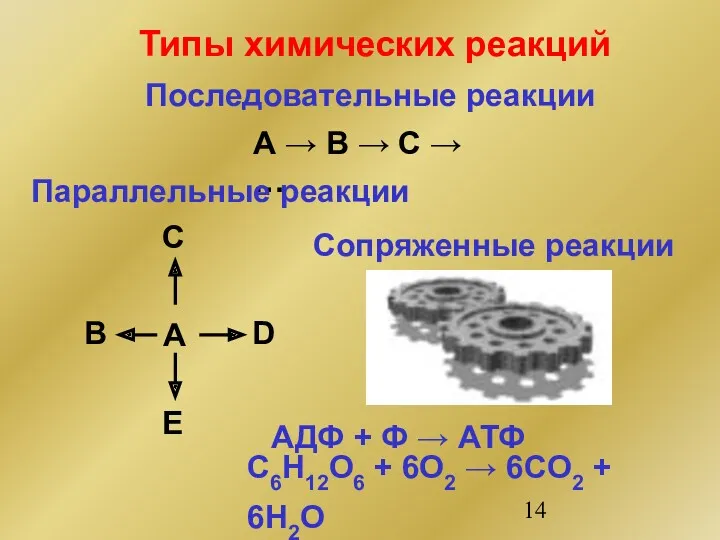
- 14. Последовательные реакции А → B → C → … Параллельные реакции A B C D E
- 15. Уравнение Вант-Гоффа – температурный коэффициент (2 - 4) γ = 2 ΔT = 10 При увеличении
- 16. Эффективные соударения
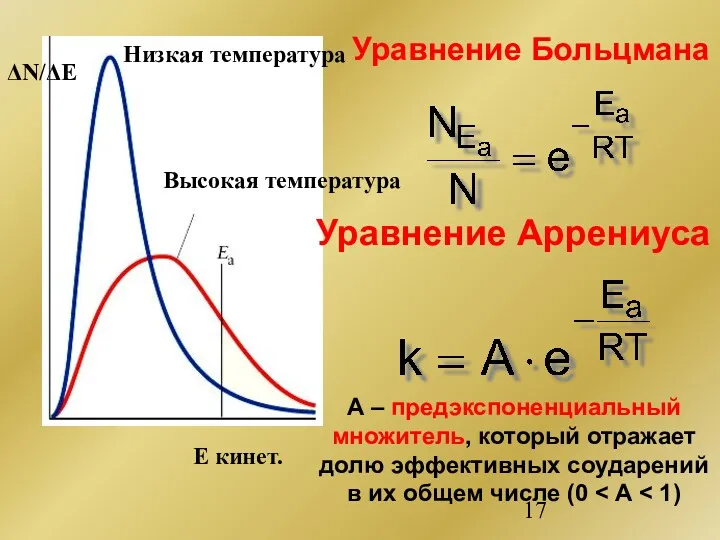
- 17. Низкая температура Высокая температура Е кинет. ΔN/ΔE Уравнение Больцмана Уравнение Аррениуса А – предэкспоненциальный множитель, который
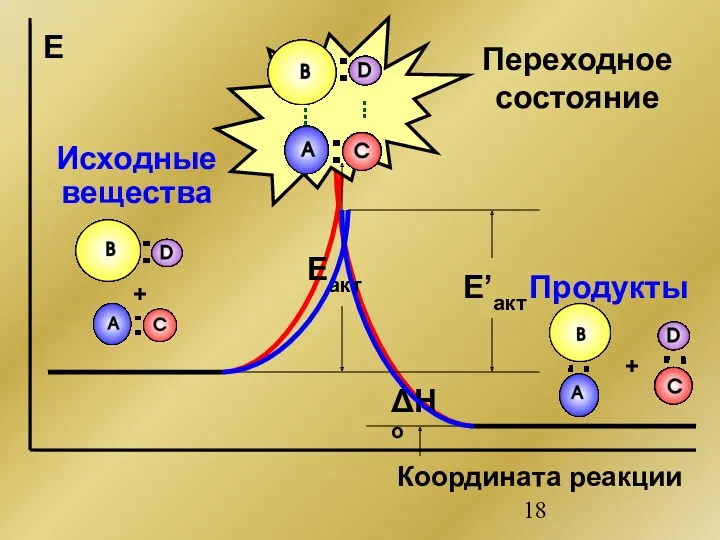
- 18. + + ΔHo Eакт Е Координата реакции Продукты Исходные вещества Переходное состояние E’акт
- 19. H2O2 → H2O + O Катализ Еа, кДж/моль - 75 1 MnO2 48 2.104 каталаза 23
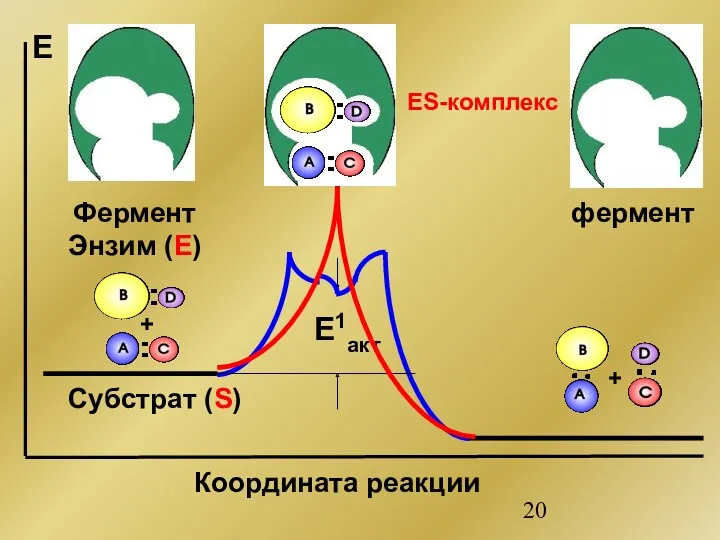
- 20. + + E1акт Е Координата реакции Фермент Энзим (Е) фермент ES-комплекс Субстрат (S)
- 21. aA + bB cC + dD Обратимость – способность реакции протекать в двух направлениях Условия химического
- 22. Для реакции aA + bB + … dD + eE + … где [A], [B]… -
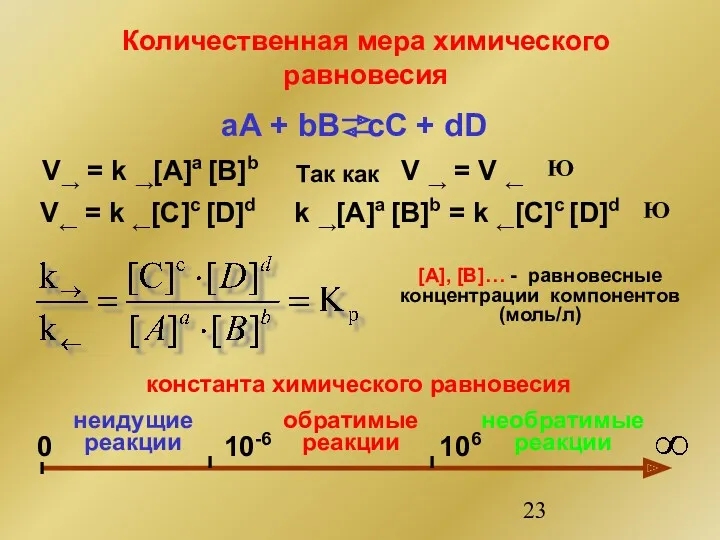
- 23. Количественная мера химического равновесия aA + bB cC + dD V→ = k →[A]a [B]b V←
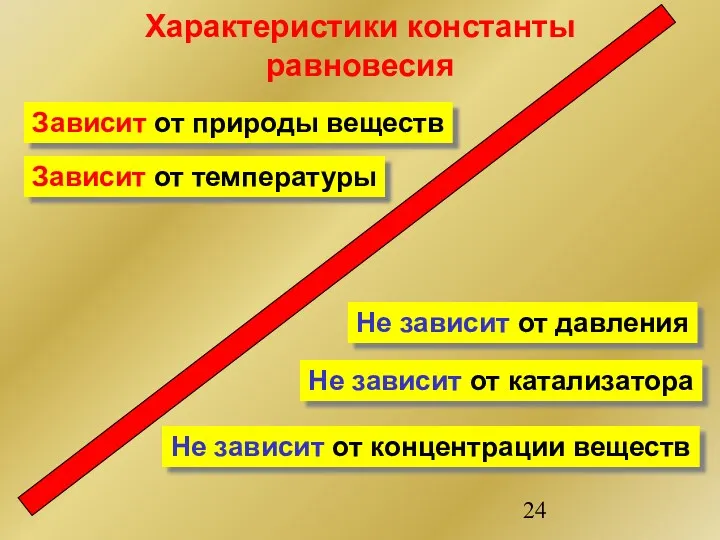
- 24. Характеристики константы равновесия Не зависит от концентрации веществ Не зависит от давления Не зависит от катализатора
- 25. Равновесие в биокомплексах Гемоглобин (Hb) Hb + O2 Hb.O2 Hb + CO Hb.CO Hb.CO + O2
- 26. Смещение химического равновесия Принцип Ле-Шателье Если на равновесную систему производится внешнее воздействие, то равновесие смещается в
- 27. Влияние концентрации FeCl3 + 3KCNS Fe(CNS)3 + 3KCl Так как величина Кр не зависит от концентрации:
- 28. При ΔHo T2, ln K1/K2 то есть K1 процесса при понижении температуры происходит увеличение Kравн., что
- 29. Влияние давления 2H2 + O2 2H2O Пусть р2 = 2р1: V1 → = k →[H2]2[O2] V2
- 30. Правило Бертло Равновесие будет смещаться в одном направлении, если какой-либо из продуктов будет покидать сферу реакции,
- 32. Скачать презентацию




















 А.С. Пушкин, стихотворение Зимнее утро
А.С. Пушкин, стихотворение Зимнее утро ООО СЕВНОР Логистик
ООО СЕВНОР Логистик Analysis of the formation and execution of the state budget of the republic of Kazakhstan
Analysis of the formation and execution of the state budget of the republic of Kazakhstan Источники энергии. Безуглеродный мир
Источники энергии. Безуглеродный мир Б.Заходер. Песенки Винни–Пуха
Б.Заходер. Песенки Винни–Пуха Презентация к уроку по климату России
Презентация к уроку по климату России Формирование связной речи (по методике Т.А.Ткаченко)
Формирование связной речи (по методике Т.А.Ткаченко) Коммутационное оборудование
Коммутационное оборудование Портфолио воспитателя
Портфолио воспитателя Постмодернізм._2_
Постмодернізм._2_ Итальянские сады эпохи Возрождения
Итальянские сады эпохи Возрождения Презентации уроков и контрольно-измерительные материалы к предмету География Иркутской области (9 класс) Диск
Презентации уроков и контрольно-измерительные материалы к предмету География Иркутской области (9 класс) Диск Кровь и её состав. Группы крови
Кровь и её состав. Группы крови Узлы
Узлы Древняя Русь
Древняя Русь Театр и киноискусство XX века: культурная дополняемость (урок 1)
Театр и киноискусство XX века: культурная дополняемость (урок 1) Презентация по теме Образование в Англии
Презентация по теме Образование в Англии Филяриидоздарға жалпы сипаттама . Алдын алу және эпидемияға қарсы шараларды ұйымдастыру
Филяриидоздарға жалпы сипаттама . Алдын алу және эпидемияға қарсы шараларды ұйымдастыру Робототехника WeDo 2.0
Робототехника WeDo 2.0 Презентация к уроку Погода и климат 5 класс Плешаков Сонин
Презентация к уроку Погода и климат 5 класс Плешаков Сонин Ислам. Мусульмане
Ислам. Мусульмане Время. Скорость. Расстояние
Время. Скорость. Расстояние Детский церебральный паралич
Детский церебральный паралич ОРВИ, грипп, острый бронхит
ОРВИ, грипп, острый бронхит Методические указания для выполнения индивидуальных заданий. Проверка статистических гипотез
Методические указания для выполнения индивидуальных заданий. Проверка статистических гипотез 20230416_na_rmo_vystuplenie
20230416_na_rmo_vystuplenie Государство и его функции (обществознание)
Государство и его функции (обществознание) Окружающая среда
Окружающая среда