Слайд 2

Основных оксидов:
с кислотами = растворимая соль + Н2О
с Н2О = основание
(оксиды щелочных, щелочноземельных Ме, Mg)
с кислотным оксидом = соль
с амфотерным оксидом = соль
с Н2,С,СО, Al, Mg = Ме + … ( пирометаллургия)
Слайд 3

Кислотных оксидов:
со щелочами = соль + Н2О
со щелочами = кислая соль
с
Н2О = кислота ( оксиды неМе кроме SiO2 )
с основными оксидами = соль
с амфотерными оксидами = соль
с солями летучих кислот = соль + кислотный оксид (газ)
Слайд 4

Амфотерных оксидов:
с кислотами = растворимая соль + Н2О
с основными, кислотными оксидами
или друг с другом = соль
с расплавами щелочей = соль + Н2О
с растворами щелочей = комплексная соль
Al2O3+2NaOH+3H2O=2Na(Al(OH)4)
Слайд 5

Нерастворимых оснований:
с кислотами = растворимая соль + Н2О (нейтрализация)
разложение при t0
= оксид Ме + Н2О
Слайд 6

Щелочей:
изменение окраски индикатора (диссоциация ОН-)
с кислотами = растворимая соль + Н2О
(нейтрализация)
с солями (необратимая реакция)
с кислотными оксидами = кислая соль или средняя соль + Н2О
с амфотерными оксидами = соль (t0) или комплексная соль (раствор)
с Ме (Al, Zn) в растворе = комплексная соль + Н2
с неМе (Гал2) : 2F2 + 2NaOH (хол) = 2NaF + H2O + OF2
Cl2 + 2KOH (хол) = KCl + KClO + H2O
3Cl2 + 6KOH (гор) = 5KCl + KClO3 + H2O
Cl2 + Ca(OH)2 = CaOCl2 + H2O
возможен электролиз расплавов
Слайд 7

Щелочей:
с органическими веществами:
с галогеналканами (водн. р-р) = спирт + МеГ
с галогеналканами
(спирт. р-р) = алкен или алкин + МеГ + Н2О
с фенолами (но не со спиртами) = фенолят Ме + Н2О
со сложными эфирами (жирами)= CnH2n+1COOMe + спирт (глицерин) - щелочной гидролиз
с кислотами и аминокислотами = соль + Н2О
Слайд 8

Амфотерных оснований:
с кислотами = растворимая соль + Н2О (нейтрализация)
разложение при t0
= оксид Ме + Н2О
со щелочами (расплав) = соль + Н2О
со щелочами (раствор) = комплексная соль
Слайд 9

Кислот:
диссоциация на ионы, изменение цвета индикатора;
с Ме до Н = растворимая
соль + Н2 (кроме HNO3, H2SO4(конц.)
с основаниями (нейтрализация) = кислая, средняя или основная соль + Н2О
с основными и амфотерными оксидами = растворимая соль + Н2О
с солями = реакция обмена (газ, осадок или Н2О)
со спиртами = сложные эфиры + Н2О
с неМе = ОВР H2S + I2= 2HI + S
HNO3 + C, S, (P+ Н2О)
H2SO4(конц.) + C,S
HCl + окислители = ОВР HCl + MnO2 = MnCl2 + Cl2 + Н2О
HNO3, H2SO4(конц.) + Mе = соль + Н2О + соединение S или N
HNO3 + алканы = нитроалкан + Н2О (реакция замещения Коновалова)
с аминами и аминокислотами = соединение по донорно- акцепторному механизму
возможен электролиз
Слайд 10

Солей:
с Ме (кроме активных, электрохимический ряд Ме) = соль + Ме
со
щелочами = соль + основание (осадок, газ)
с кислотами = средняя или кислая соль + кислота (газ, осадок, Н2О
возможен гидролиз (изменение цвета индикатора)
возможен электролиз (изменение цвета индикатора)
совместный гидролиз в растворе
с солями (осадок)
с неМе: 2KI + Cl2 = 2KCl + I2
2FeCl2 + Cl2 = 2FeCl3
разложение нитратов : (акт. Ме, до Си, левее Си)
NH4NO2 = N2 + 2Н2О
NH4NO3 = N2O + 2Н2О
с нелетучими оксидами соли летучих кислот
Слайд 11

Металлов:
с растворами кислот (Ме до Н)= растворимая соль + Н2 (кроме
HNO3, H2SO4(конц.)
Mе + HNO3, H2SO4(конц.) = соль + Н2О + соединение S или N
с Н2О = основание + Н2 (Ме до Al)
с Н2О = оксид Ме + Н2 (Ме после Al до Н)
с неМе = соль или оксид (пероксид)
Ме (кроме активных, электрохимический ряд Ме) с солями = соль + Ме
Al, Mg, Ca + оксиды Ме (в металлургии)
Al, Zn с растворами щелочей = комплексная соль + Н2
Ме средней активности с угарным газом (СО)
со спиртами и фенолами = соль + Н2
с галогеналканами = циклоалкан (Zn) или алкан с длинной цепью (Na)- реакция Вюрца
с карбоновыми кислотами и аминокислотами (Ме до Н) = соль + Н2
Na с первичными алкинами (реакция замещения)










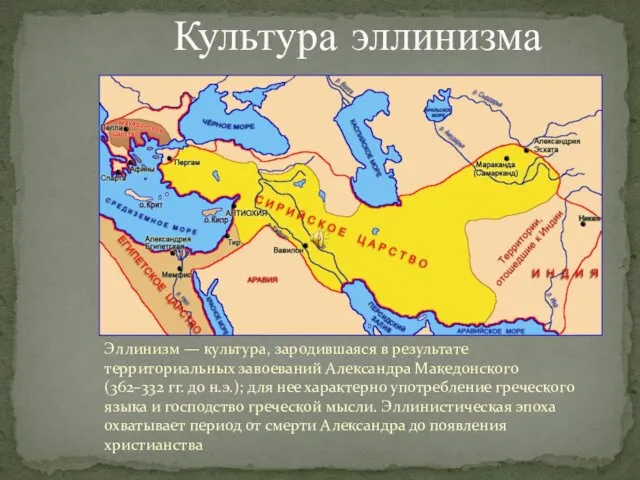 Культура Эллинизма
Культура Эллинизма 1С Парфюм Логистик
1С Парфюм Логистик Применение нетрадиционных источников энергии в Чувашской Республике
Применение нетрадиционных источников энергии в Чувашской Республике zanyatie_10_pro_zaychat_i_zaychihu
zanyatie_10_pro_zaychat_i_zaychihu Джон Эверетт Милле (John Everett Millais)
Джон Эверетт Милле (John Everett Millais) Мои земляки - труженики полей
Мои земляки - труженики полей Перу. План описания страны Латинской Америки
Перу. План описания страны Латинской Америки Имя прилагательное.Суффиксы прилагательных
Имя прилагательное.Суффиксы прилагательных Культура ислама. Основы духовно – нравственной культуры народов России
Культура ислама. Основы духовно – нравственной культуры народов России Что такое дисграфия и как с ней бороться?
Что такое дисграфия и как с ней бороться? Секреты семейного воспитания
Секреты семейного воспитания Презентация Игра в жизни ребенка
Презентация Игра в жизни ребенка E-learning и дистанционные технологии
E-learning и дистанционные технологии Microsoft Office Power Point
Microsoft Office Power Point Луч и угол
Луч и угол Глобальная энергетическая и сырьевая проблема
Глобальная энергетическая и сырьевая проблема Система мотивации за инновационные проекты
Система мотивации за инновационные проекты Тема поэта и поэзии в лирике А.С. Пушкина
Тема поэта и поэзии в лирике А.С. Пушкина Шляпный этикет, как правильно вписать аксессуар из прошлого в современный образ
Шляпный этикет, как правильно вписать аксессуар из прошлого в современный образ Кабинет географии
Кабинет географии Кроссворд Что мы знаем о пчёлах
Кроссворд Что мы знаем о пчёлах Органы растений. Побег
Органы растений. Побег Газообразное состояние вещества
Газообразное состояние вещества Гидроэлектростанции. Типы ГЭС
Гидроэлектростанции. Типы ГЭС Жигули. ОАО АвтоВАЗ
Жигули. ОАО АвтоВАЗ Отчет по искусствоведческой практике. Шаблон
Отчет по искусствоведческой практике. Шаблон Презентация Интеллектуальное развитие дошкольников
Презентация Интеллектуальное развитие дошкольников Винсент Ван Гог - краткая биография и картины художника
Винсент Ван Гог - краткая биография и картины художника