Содержание
- 2. Количество гидроксогрупп определяется валентностью металла, образующего основание Валентность гидроксогруппы – Например: KOH, Ca(OH)2, Fe(OH)3
- 3. Название оснований Гидроксид + Название металла в родительном падеже + Валентность римскими цифрами, если металл с
- 4. Запишите формулы гидроксидов гидроксид натрия, гидроксид кальция, гидроксид железа (III), гидроксид калия, гидроксид алюминия, гидроксид магния
- 5. Классификация оснований по растворимости Растворимые в воде (щелочи) Нерастворимые в воде NaOH Ca(OH)2 Al(OH)3 Сu(OH)2 Мg(OH)2
- 6. Классификация оснований по числу гидроксогрупп
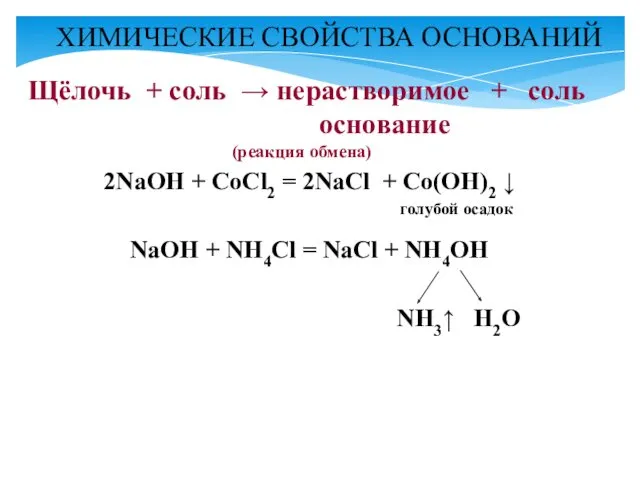
- 7. Химические свойства оснований, их применение. Реакция нейтрализации.
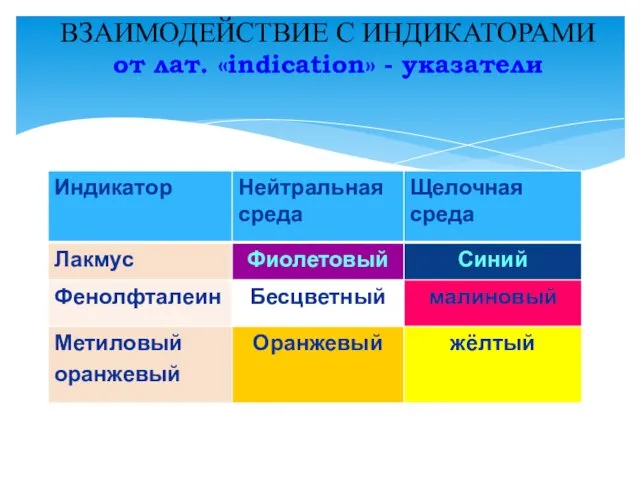
- 8. ВЗАИМОДЕЙСТВИЕ С ИНДИКАТОРАМИ от лат. «indication» - указатели
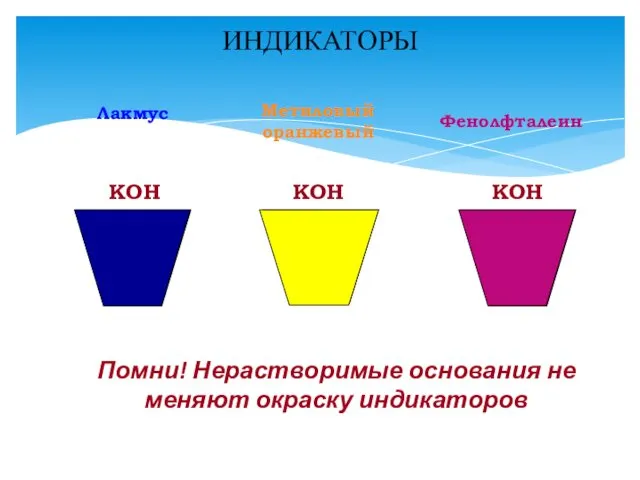
- 9. ИНДИКАТОРЫ КOH КOH КOH Лакмус Метиловый оранжевый Фенолфталеин Помни! Нерастворимые основания не меняют окраску индикаторов
- 10. Щёлочь + оксид неметалла → соль + вода (кислотный оксид) (реакция обмена) УСЛОВИЕ: оксиду неметалла должна
- 11. 2NaOH + CoCl2 = 2NaCl + Co(OH)2 ↓ голубой осадок NaOH + NH4Cl = NaCl +
- 12. Основание + кислота → соль + вода (реакция обмена, нейтрализации) Растворимые основания: NaOH + HCl →
- 13. (разложение при нагревании) Нерастворимое основание → оксид металла + вода Mg(OH)2 → MgO + H2O Сu(OH)2
- 14. ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С ЩЕЛОЧАМИ 2Al + 2NaOH + 2H2O = 2Na[Al(OH)4] + 3H2↑ Тетрагидроксоалюминат натрия
- 16. Скачать презентацию









![ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С ЩЕЛОЧАМИ 2Al + 2NaOH + 2H2O = 2Na[Al(OH)4] + 3H2↑ Тетрагидроксоалюминат натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/78061/slide-13.jpg)
 Модель парной линейной регрессии
Модель парной линейной регрессии Кейс. Прототип цифровой платформы для сети магазинов Водяной
Кейс. Прототип цифровой платформы для сети магазинов Водяной История развития педагогики
История развития педагогики Учебные программы коррекционной школы .
Учебные программы коррекционной школы . Гипердинамикалық септикалық шоктың еміндегі норадреналин немесе допамин
Гипердинамикалық септикалық шоктың еміндегі норадреналин немесе допамин валенки
валенки 5 класс обобщающий урок к разделу Вселенная
5 класс обобщающий урок к разделу Вселенная Что такое информация
Что такое информация Логарифм. Логарифмическая функция. Логарифмические уравнения и неравенства
Логарифм. Логарифмическая функция. Логарифмические уравнения и неравенства Звёздный час
Звёздный час Характер современных войн и вооруженных конфликтов
Характер современных войн и вооруженных конфликтов Искусство по шагам. Шаг 5. Арт-словарь ХХ века. Абстракционизм
Искусство по шагам. Шаг 5. Арт-словарь ХХ века. Абстракционизм International ice sculpture festival in Jelgava
International ice sculpture festival in Jelgava Портфолио учащегося
Портфолио учащегося Святая блаженная Матрона Московская
Святая блаженная Матрона Московская Хвороба поліомієліт
Хвороба поліомієліт Комплектующие ПК
Комплектующие ПК Русский язык, 2 класс (подготовка к ВПР)
Русский язык, 2 класс (подготовка к ВПР) Типы виброизоляторов (амортизаторов), их выбор и размещение
Типы виброизоляторов (амортизаторов), их выбор и размещение Психология двигательно-волевой сферы психической деятельности
Психология двигательно-волевой сферы психической деятельности Технология сохранения и стимуляция здоровья в подвижных играх в жизни дошкольников
Технология сохранения и стимуляция здоровья в подвижных играх в жизни дошкольников Игра Звёздный час
Игра Звёздный час Формирование имиджа современного педагога
Формирование имиджа современного педагога Промышленные здания
Промышленные здания Дизайн-концепция организации общественного пространства Тёплый дом
Дизайн-концепция организации общественного пространства Тёплый дом Занимательные задачи по черчению. 8 класс
Занимательные задачи по черчению. 8 класс Проблема государственной задолженности Украины
Проблема государственной задолженности Украины Краеведение. Город Колпино.
Краеведение. Город Колпино.