Содержание
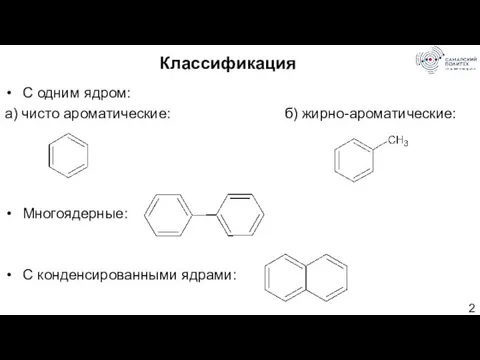
- 2. Классификация С одним ядром: а) чисто ароматические: б) жирно-ароматические: Многоядерные: С конденсированными ядрами:
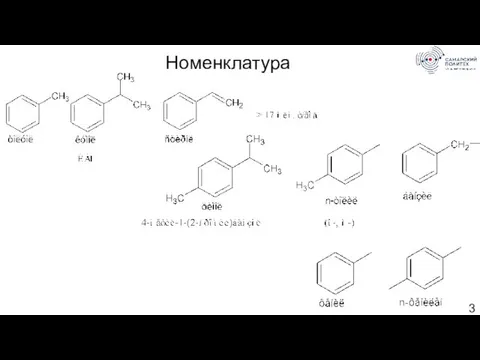
- 3. Номенклатура
- 4. Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень): Для дизамещенных бензолов R-C6H4-R
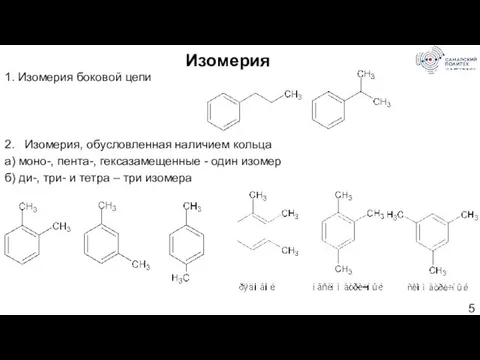
- 5. Изомерия 1. Изомерия боковой цепи 2. Изомерия, обусловленная наличием кольца а) моно-, пента-, гексазамещенные - один
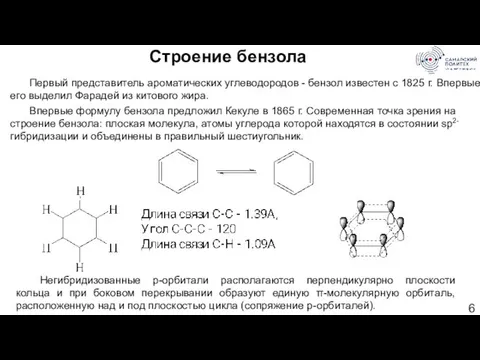
- 6. Строение бензола Первый представитель ароматических углеводородов - бензол известен с 1825 г. Впервые его выделил Фарадей
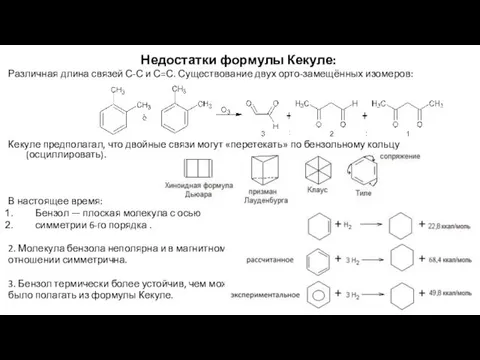
- 7. Недостатки формулы Кекуле: Различная длина связей С-С и С=С. Существование двух орто-замещённых изомеров: Кекуле предполагал, что
- 8. Критерии ароматичности Правило Хюккеля — плоские циклические соединения, содержащие замкнутую систему (4n+2) π-электронов, являются ароматическими n=0,1,2,3
- 9. Строение бензола Энергия сопряжения 36,6 ккал/моль. Все атомы С находятся в состоянии sp2-гибридизации. Все длины связей
- 10. Способы получения 1. Из каменноугольной смолы: (уголь, 1000оС, без доступа воздуха, образуются:) а) светильный газ (300м3
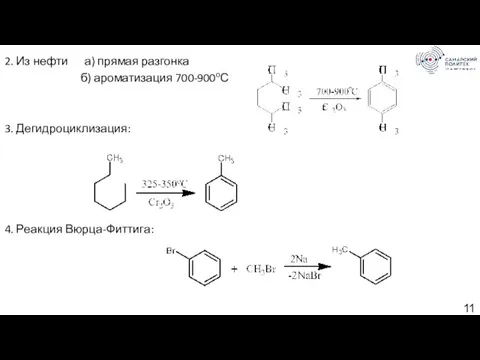
- 11. 2. Из нефти а) прямая разгонка б) ароматизация 700-900оС 3. Дегидроциклизация: 4. Реакция Вюрца-Фиттига:
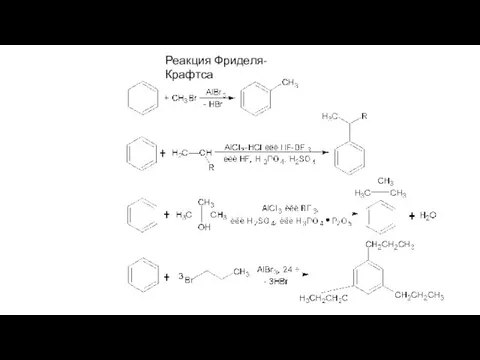
- 12. Реакция Фриделя-Крафтса
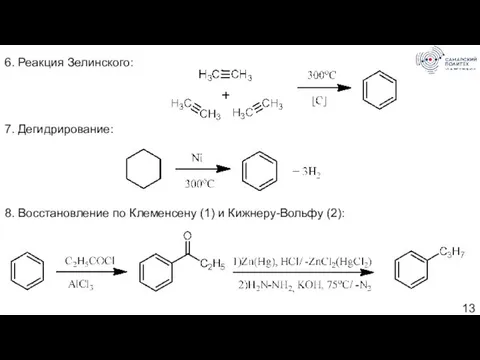
- 13. 6. Реакция Зелинского: 7. Дегидрирование: 8. Восстановление по Клеменсену (1) и Кижнеру-Вольфу (2):
- 14. Физические свойства Ароматические соединения - жидкости или твердые вещества, отличающиеся от своих алифатических и алициклических аналогов
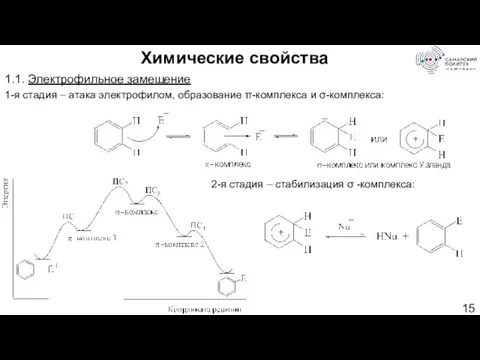
- 15. Химические свойства 1.1. Электрофильное замещение 1-я стадия – атака электрофилом, образование π-комплекса и σ-комплекса: 2-я стадия
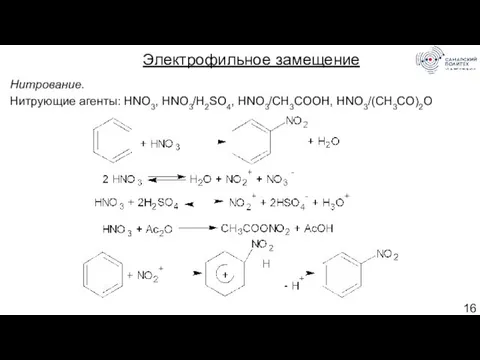
- 16. Нитрование. Нитрующие агенты: HNO3, HNO3/H2SO4, HNO3/CH3COOH, HNO3/(CH3CO)2O Электрофильное замещение
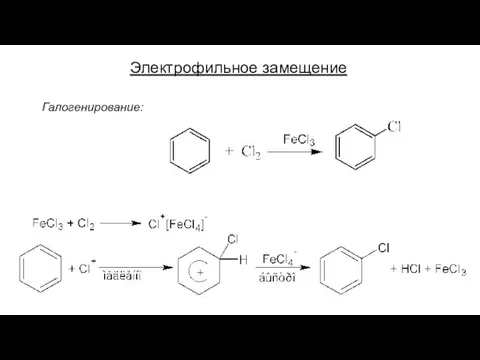
- 17. Электрофильное замещение Галогенирование:
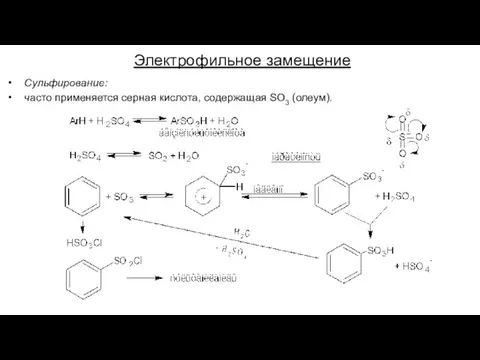
- 18. Электрофильное замещение Сульфирование: часто применяется серная кислота, содержащая SO3 (олеум).
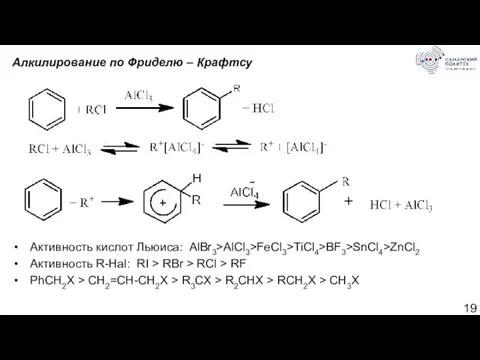
- 19. Алкилирование по Фриделю – Крафтсу Активность кислот Льюиса: AlBr3>AlCl3>FeCl3>TiCl4>BF3>SnCl4>ZnCl2 Активность R-Hal: RI > RBr > RCl
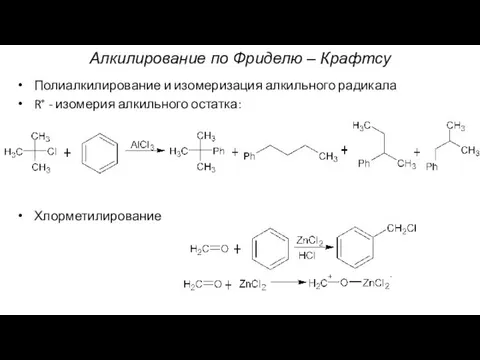
- 20. Алкилирование по Фриделю – Крафтсу Полиалкилирование и изомеризация алкильного радикала R+ - изомерия алкильного остатка: Хлорметилирование
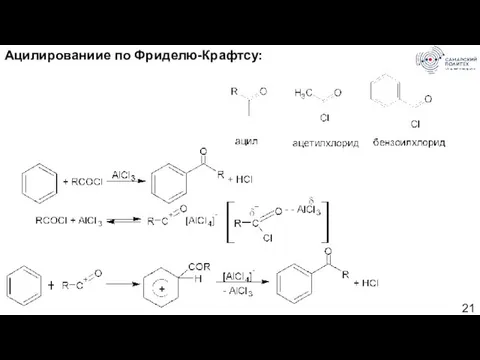
- 21. Ацилированиие по Фриделю-Крафтсу:
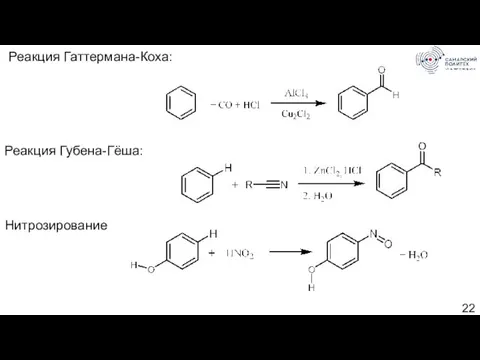
- 22. Реакция Гаттермана-Коха: Реакция Губена-Гёша: Нитрозирование
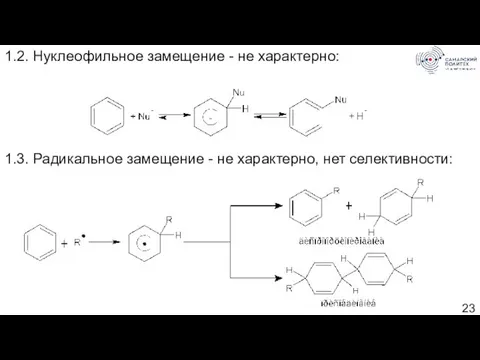
- 23. 1.2. Нуклеофильное замещение - не характерно: 1.3. Радикальное замещение - не характерно, нет селективности:
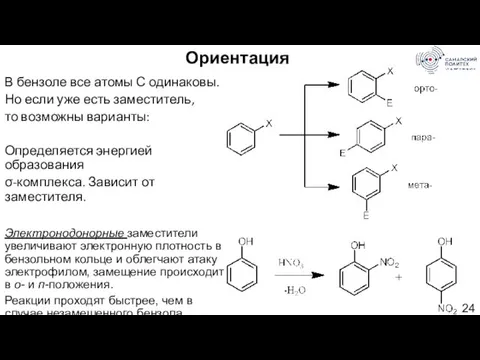
- 24. Ориентация В бензоле все атомы С одинаковы. Но если уже есть заместитель, то возможны варианты: Определяется
- 25. По селективности ориентации: Активация орто- и пара- положения: По скорости реакции: Cl, Br, I, F ориентируют
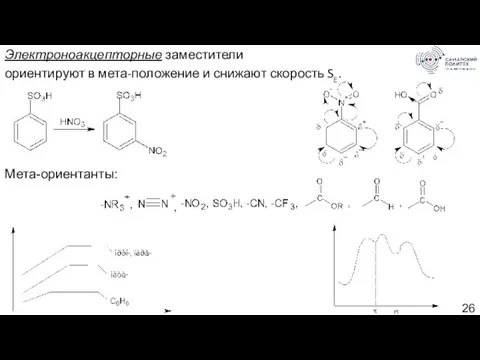
- 26. Электроноакцепторные заместители ориентируют в мета-положение и снижают скорость SE. Мета-ориентанты:
- 27. Влияние заместителей в бензольном ядре на электрофильное замещение
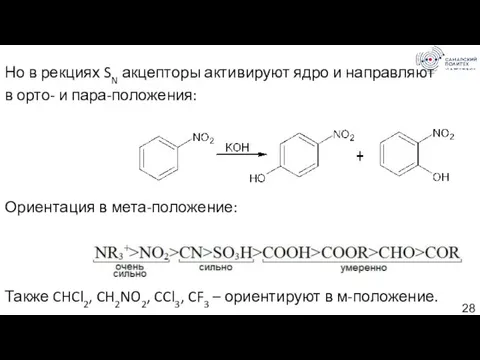
- 28. Но в рекциях SN акцепторы активируют ядро и направляют в орто- и пара-положения: Ориентация в мета-положение:
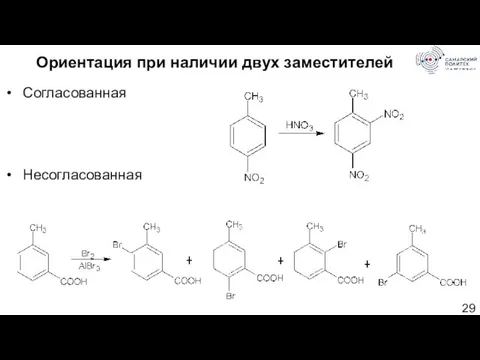
- 29. Ориентация при наличии двух заместителей Согласованная Несогласованная
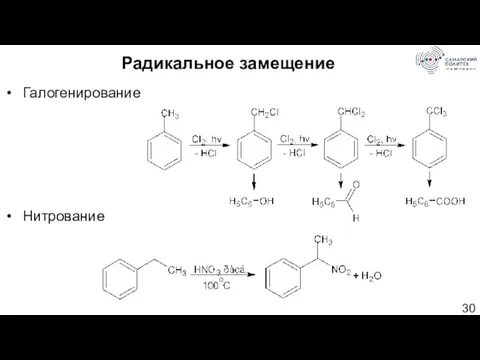
- 30. Радикальное замещение Галогенирование Нитрование
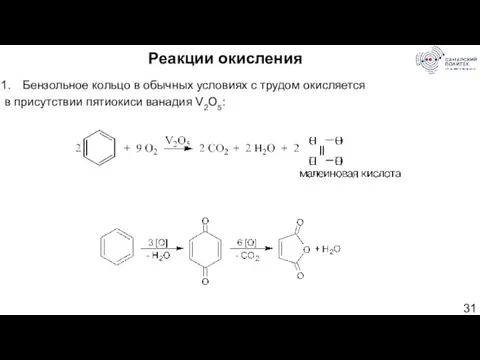
- 31. Реакции окисления Бензольное кольцо в обычных условиях с трудом окисляется в присутствии пятиокиси ванадия V2O5:
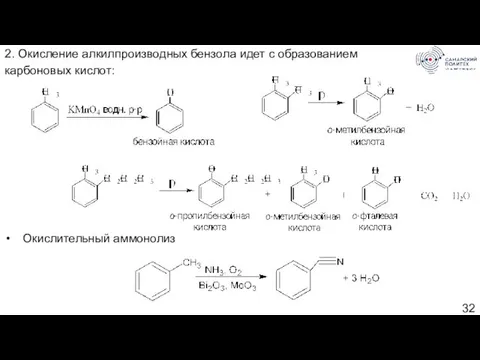
- 32. 2. Окисление алкилпроизводных бензола идет с образованием карбоновых кислот: Окислительный аммонолиз
- 34. Скачать презентацию







 Сентиментализм. Сентименталистское и сентиментальное
Сентиментализм. Сентименталистское и сентиментальное Традиции семьи в русских народных пословицах и поговорках
Традиции семьи в русских народных пословицах и поговорках Мел МКОУ Никольская-1 СОШ Шехавцов
Мел МКОУ Никольская-1 СОШ Шехавцов Аппаратное обеспечение для персонального компьютера
Аппаратное обеспечение для персонального компьютера Дополнительные услуги в гостинице
Дополнительные услуги в гостинице Алмазная россыпь Наш край
Алмазная россыпь Наш край Где нельзя играть. Уроки Веселого Светофора
Где нельзя играть. Уроки Веселого Светофора Электромагнитное взаимодействие
Электромагнитное взаимодействие Виникнення козацтва та утворення Запорізької Січі
Виникнення козацтва та утворення Запорізької Січі Wedding traditions in different countries
Wedding traditions in different countries Качество работы почтовой связи
Качество работы почтовой связи США в 1945-2017 гг
США в 1945-2017 гг INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06
INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06 Федеральный закон от 06.12.2011 N 402-ФЗ О бухгалтерском учете
Федеральный закон от 06.12.2011 N 402-ФЗ О бухгалтерском учете Обычаи и традиции народов России
Обычаи и традиции народов России Храм как Сад
Храм как Сад Культура России первой половины 19 века
Культура России первой половины 19 века КАДЕТЫ РОСИИ
КАДЕТЫ РОСИИ Детские книги Наринэ Абгарян
Детские книги Наринэ Абгарян Лазерные системы сигнализации на железнодорожных переездах
Лазерные системы сигнализации на железнодорожных переездах К выступлению учителя-логопеда на родительском собрании в подготовительной группе с ФФНР
К выступлению учителя-логопеда на родительском собрании в подготовительной группе с ФФНР Храм. Основы Православной культуры
Храм. Основы Православной культуры Искусство в религиозной культуре
Искусство в религиозной культуре Группа в социальном пространстве. Признаки и функции коллектива, методика его формирования
Группа в социальном пространстве. Признаки и функции коллектива, методика его формирования Назначение и устройство редуктора и стабилизатора КМ 394
Назначение и устройство редуктора и стабилизатора КМ 394 Круговые процессы (циклы)
Круговые процессы (циклы) Гибка тонколистового металла и проволоки
Гибка тонколистового металла и проволоки С новым Годом, друзья!
С новым Годом, друзья!