Слайд 2

Слайд 3

ПОДУМАЕМ И ОТВЕТИМ. (ДА ИЛИ НЕТ)
1. Сера располагается в 6
главной группе ПС .
2.На внешнем энергетическом уровне у серы два электрона.
3. Сера – неметалл.
4.Сере легче принять два электрона, чем отдать шесть.
5. Сера типичный восстановитель.
6. Порядок распределения электронов по уровням 2 8 6
7. У серы окислительные свойства выражены сильнее, чем у кислорода.
8. Всего у серы 16 протонов и 16 электронов.
9.Минимальная степень окисления серы -2.
10.В соединении с кислородом сера может проявлять степени окисления +2, +4, +6
Слайд 4
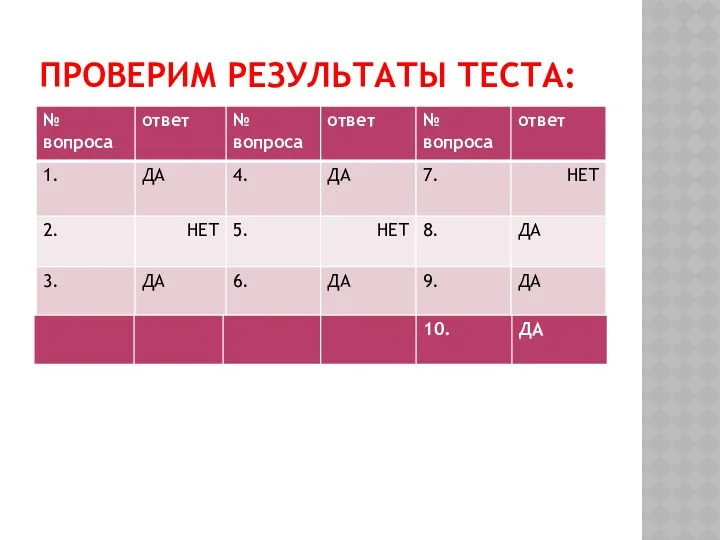
ПРОВЕРИМ РЕЗУЛЬТАТЫ ТЕСТА:
Слайд 5

Слайд 6

Тема урока:
«Серная кислота и её свойства»
(1 урок)
Я растворю
любой металл.
Меня алхимик получал
В реторте глиняной простой.
Слыву я главной кислотой...
Когда сама я растворяюсь
В воде, то сильно нагреваюсь.
Слайд 7

ЦЕЛЬ УРОКА:
Изучить свойства разбавленной серной кислоты и выявить общие свойства
, которые характерны для кислот, а так же специфические, которые обусловлены…
Слайд 8

«Лучший путь к истине – это изучать вещи, как они есть,
а не верить, что они такие, как нас этому учили».
Д.Локк
Слайд 9
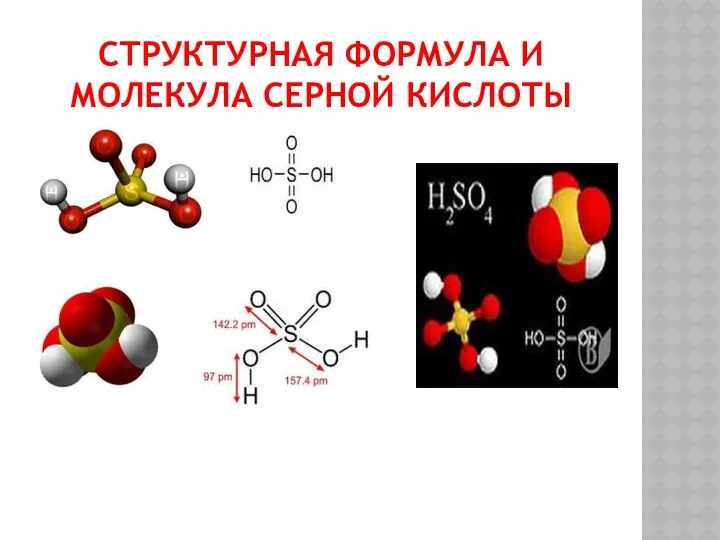
СТРУКТУРНАЯ ФОРМУЛА И МОЛЕКУЛА СЕРНОЙ КИСЛОТЫ
Слайд 10

ФИЗИЧЕСКИЕ СВОЙСТВА
СЕРНОЙ КИСЛОТЫ
Безводная серная кислота - это бесцветная маслянистая жидкость
без запаха,
смешивается с водой в любых отношениях,
t пл. =10,30 С, t кип = 2960С, плотность=1, 84 г/см3. Обладает сильным водоотнимающим действием.
Слайд 11

ХИМИЧЕСКИЕ СВОЙСТВА РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ
Взаимодействует :
с оксидами металлов
Н2SO4+MeO→MeSO4+H2O
(
образуется соль и вода)
с основаниями
Н2SO4+Me(OН)n→MeSO4+H2O
( образуется соль и вода)
с солями
Н2SO4+MeR(р)→MeSO4 (р)+HR
( образование осадка или выделение газа)
Слайд 12

РАЗБАВЛЕННАЯ И КОНЦЕНТРИРОВАННАЯ СЕРНЫЕ КИСЛОТЫ ВЕДУТ СЕБЯ ПО- РАЗНОМУ ПО
ОТНОШЕНИЮ К МЕТАЛЛАМ
РАЗБАВЛЕННАЯ СЕРНАЯ КИСЛОТА ВЕДЕТ СЕБЯ, КАК СИЛЬНАЯ КИСЛОТА. АКТИВНЫЕ МЕТАЛЛЫ, СТОЯЩИЕ В РЯДУ НАПРЯЖЕНИЙ ЛЕВЕЕ ВОДОРОДА
LI, К, CA, NA, MG, AL, MN, ZN, FE, CO, NI, SN, PB, H2, CU,HG, AG, AU
ВЫТЕСНЯЮТ ВОДОРОД ИЗ РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ. МЫ ВИДИМ ПУЗЫРЬКИ ВОДОРОДА ПРИ ДОБАВЛЕНИИ РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ В ПРОБИРКУ С ЦИНКОМ.
H2SO4 + ZN = ZN SO4 + H2 ↑
МЕДЬ СТОИТ В РЯДУ НАПРЯЖЕНИЙ ПОСЛЕ ВОДОРОДА – ПОЭТОМУ РАЗБАВЛЕННАЯ СЕРНАЯ КИСЛОТА НЕ ДЕЙСТВУЕТ НА МЕДЬ.
Слайд 13

ЛАБОРАТОРНЫЕ ОПЫТЫ: ХИМИЧЕСКИЕ СВОЙСТВА
РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ
1. Ознакомьтесь с инструкцией по выполнению
лабораторных опытов.
2.При выполнении опытов соблюдайте правила техники безопасности.
3.Отчет о работе оформите в таблице.
4. Сделайте вывод о результатах эксперимента.
5. Приведите рабочее место в порядок
Слайд 14

Слайд 15

ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ОБРАЩЕНИЯ С H2SO4
1. Обращаться осторожно.
2. Работать
в резиновых перчатках
и защитных очках.
3. Берегись ожога. Во избежание
разбрызгивания и появления
ожогов кислоту необходимо
тонкой струей наливать в воду, а
не наоборот.
4. При попадании кислоты на кожу
необходимо смыть кислоту
большим количеством проточной
воды, а пострадавшее место
затем аккуратно обработать
раствором питьевой соды и вновь
промыть водой.
Слайд 16

ПРОВЕРИМ СВОИ ЗНАНИЯ!
Выберите, с какими из перечисленных веществ реагирует разбавленная
серная кислота:
цинк,
оксид меди(II),
гидроксид натрия,
хлорид бария.
Составьте уравнения возможных реакций.
Слайд 17

КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-ИОН
Сера образует ряд кислот. Соли
серной кислоты H2SO4 называют
сульфатами. Качественная реакция
на сульфат –ион реакция с растворимой
солью бария. Возьмем раствор сульфата натрия и серной кислоты добавим в пробирки раствор хлорида бария:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
BaCl2 + Н2SO4 = BaSO4↓ + 2НCl
В двух пробирках появляются белые кристаллические осадки сульфата бария. При добавлении раствора азотной кислоты осадок сульфата бария остается без изменения.
Слайд 18

Опыт - единственно
верный путь
спрашивать природу
и слышать ответ в
её
лаборатории.
Д.И Менделеев
Слайд 19

ЭКСПЕРИМЕНТАЛЬНАЯ ЗАДАЧА
В пробирках под номерами даны растворы:
хлорида натрия,
сульфата натрия,
иодида натрия,
серной кислоты.
Спланируйте ход распознавания веществ под номерами и распознайте их.
Слайд 20




















 Beward IP видеонаблюдение. Терминалы доступа (для сотрудников)
Beward IP видеонаблюдение. Терминалы доступа (для сотрудников) Советский кинематограф
Советский кинематограф Возведение зданий с металлическим каркасом
Возведение зданий с металлическим каркасом Притча Чем жил
Притча Чем жил Мансапты жоспарлау кезеңдері
Мансапты жоспарлау кезеңдері Project: Global Social Media Plan // March Topic: Interior Riddle 5 Format: image Date: Flexible Content
Project: Global Social Media Plan // March Topic: Interior Riddle 5 Format: image Date: Flexible Content Как стать счастливой и успешной: 15 правил жизни
Как стать счастливой и успешной: 15 правил жизни Шаблон для презентаций Ко Дню Победы бежевый
Шаблон для презентаций Ко Дню Победы бежевый Применение современных технологий для построения высокоэффективных систем пожарной сигнализации и противопожарной автоматики
Применение современных технологий для построения высокоэффективных систем пожарной сигнализации и противопожарной автоматики Седьмая годовщина провозглашения Донецкой Народной Республики
Седьмая годовщина провозглашения Донецкой Народной Республики Разработка ЛВС малого предприятия
Разработка ЛВС малого предприятия Формирование системы продаж инновационного продукта
Формирование системы продаж инновационного продукта Организация деятельности кружка Резьба по дереву
Организация деятельности кружка Резьба по дереву секты и социальная безопасность
секты и социальная безопасность Профессии швейного производства
Профессии швейного производства Лингво-дидактические особенности обучения просмотровому чтению на уроках английского языка в условиях реализации ФГОС
Лингво-дидактические особенности обучения просмотровому чтению на уроках английского языка в условиях реализации ФГОС Планеты Солнечной системы. Форма, размеры и движение земли. 6 класс
Планеты Солнечной системы. Форма, размеры и движение земли. 6 класс Россия в 17 в
Россия в 17 в Золотая голова. Электронная викторина по мифу о тыкве
Золотая голова. Электронная викторина по мифу о тыкве Добывающая промышленность. Энергетика
Добывающая промышленность. Энергетика Найди своего героя
Найди своего героя ВКР: Монтаж и управление электрическим освещением
ВКР: Монтаж и управление электрическим освещением Сборка изделий из тонколистового металла, проволоки, искусственных материалов
Сборка изделий из тонколистового металла, проволоки, искусственных материалов Б А_В_Geroi_DNR
Б А_В_Geroi_DNR Поисково- исследовательский метод в работе с детьми младшего школьного возраста
Поисково- исследовательский метод в работе с детьми младшего школьного возраста кроссворд для речевого развлечения
кроссворд для речевого развлечения Подводное устьевое оборудование морских скважин. Лекция №15-18
Подводное устьевое оборудование морских скважин. Лекция №15-18 Запечатлевающая фотография
Запечатлевающая фотография