Слайд 2

Слайд 3

Атомно-молекулярная теория
Молекулы состоят из атомов.
Атомы при химических реакциях не
изменяются и не исчезают, происходит лишь их перегруппировка, т.е. образуются новые вещества.
Следовательно, их общая масса также не изменяется
Слайд 4

Основные правила составления химических уравнений:
1. В левой части уравнения пишутся формулы
веществ, вступающих в реакцию – исходные вещества.
2. В правой части – формулы получившихся веществ – продукты реакции.
3. Между исходными веществами и продуктами реакции ставится стрелка.
4. На основании закона сохранения веществ уравниваются атомы.
5.Число атомов каждого элемента в правой части равно числу атомов этого же элемента в левой части.
6. Уравнивание атомов производится с помощью подбора коэффициентов перед формулами веществ.
Слайд 5

Химическим уравнением называют условную запись химической реакции с помощью химических формул
и математических знаков.
Слайд 6

При разложении воды образуются два газообразных вещества - Н2 и О2.
H2O
H2 + O2
2H2O == 2H2 + O2
Уравнение химической реакции
Слайд 7

Алгоритм составления уравнения химической реакции
1. Записать формулы исходных веществ.
2. Справа от
формул исходных веществ (после стрелки) записать формулы продуктов реакции.
3. Расставить коэффициенты.
Слайд 8

Горение магния
Mg + O2 MgO
2Mg + O2 = 2MgO
Слайд 9
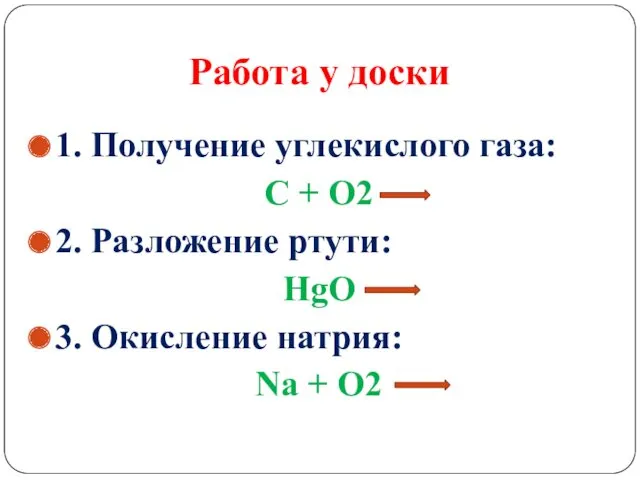
Работа у доски
1. Получение углекислого газа:
С + О2
2. Разложение ртути:
HgO
3. Окисление натрия:
Na + O2
Слайд 10

Соотношение количеств веществ, участвующих в реакции.
Коэффициенты показывают не только число молекул
каждого вещества, но и соотношение количеств веществ, которые участвуют в реакции.
Например: 2Н2 + О2 = 2Н2О
Для образования воды(2 моль) необходимо столько же моль водорода(2 моль) и в 2 раза меньше кислорода (1 моль)
Слайд 11

Задача:
Определить количество вещества кислорода, образующегося в результате разложения 4 моль воды.
Алгоритм
решения задачи:
1. Составить уравнение реакции.
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию, неизвестное берем за Х.
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти Х.










 Алфавит в стихах
Алфавит в стихах Механические колебания и волны
Механические колебания и волны Литература Возрождения
Литература Возрождения Формирование вычислительных навыков на уроках математики
Формирование вычислительных навыков на уроках математики Правовой режим земель населенных пунктов
Правовой режим земель населенных пунктов Презентация Что такое хорошо и что такое плохо
Презентация Что такое хорошо и что такое плохо Презентация игра - викторина Осень золотая
Презентация игра - викторина Осень золотая Презентация Развлечение 8 марта
Презентация Развлечение 8 марта Виртуальная выставка К 95-летию со дня рождения Виктора Астафьева
Виртуальная выставка К 95-летию со дня рождения Виктора Астафьева Презентация. Игра на тему Этикет
Презентация. Игра на тему Этикет Эволюция кровообращения
Эволюция кровообращения Наум Габо
Наум Габо Обгоняя свет
Обгоняя свет закаливание в детском саду
закаливание в детском саду Решение линейных неравенств
Решение линейных неравенств Договор комиссии
Договор комиссии Конспект индивидуального занятия в старшей группе Автоматизация звука С в словах
Конспект индивидуального занятия в старшей группе Автоматизация звука С в словах Розробка системної автоматизації процессу освітлення діоксиду титану перед фільтрацією
Розробка системної автоматизації процессу освітлення діоксиду титану перед фільтрацією Фоторепортаж из Маленькой страны. Диск
Фоторепортаж из Маленькой страны. Диск Федеральный закон Об образовании в Российской Федерацииот 29 декабря 2012 года.
Федеральный закон Об образовании в Российской Федерацииот 29 декабря 2012 года. Компьютерное сопровождение к урокам математики 5 класса по теме Десятичные дроби.
Компьютерное сопровождение к урокам математики 5 класса по теме Десятичные дроби. Химия почв
Химия почв Кубанские говоры
Кубанские говоры Автоматизація в легкій промисловості
Автоматизація в легкій промисловості Лучшие практики предприятия международных автомобильных перевозок на примере компании ИП Григорьев
Лучшие практики предприятия международных автомобильных перевозок на примере компании ИП Григорьев Электрический заряд. Электризация тел. Закон сохранения электрического заряда
Электрический заряд. Электризация тел. Закон сохранения электрического заряда Взаимосвязь биологических и социальных факторов в психическом развитии
Взаимосвязь биологических и социальных факторов в психическом развитии Емельян Иванович Пугачев
Емельян Иванович Пугачев