Содержание
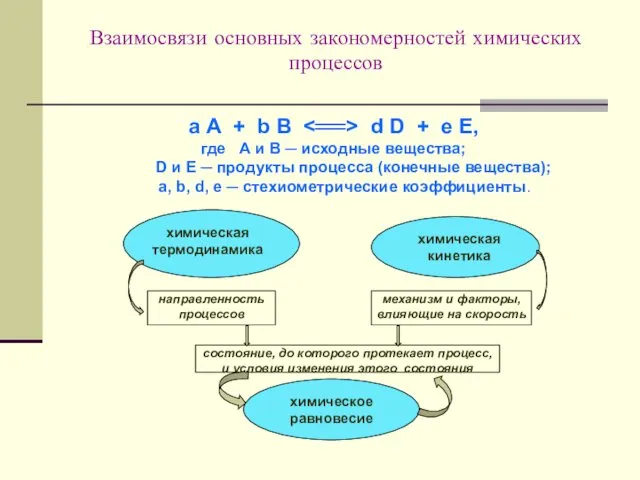
- 2. Взаимосвязи основных закономерностей химических процессов a А + b B d D + e E, где
- 3. Термодинамические параметры, характеризующие состояние термодинамической системы параметры процесса: параметры состояния ( f ): Т ─температура; U
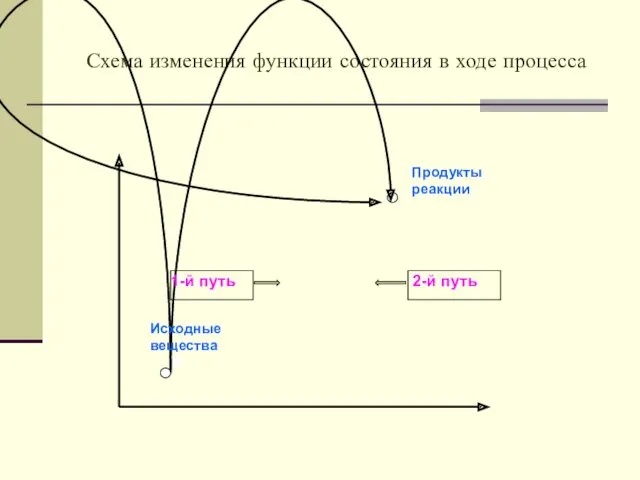
- 4. Схема изменения функции состояния в ходе процесса
- 5. Энергетика химических процессов Коровин Н.В. Общая химия. ─ М.: Высш. шк., 2000. ─ 558 с. §§
- 6. Тепловой эффект химического процесса Изменение энергии системы при протекании в ней химической реакции и условии, что
- 7. Стандартная энтальпия образования сложного вещества ─ энергетический эффект, сопрвождающий образование 1 моль сложного вещества из простых
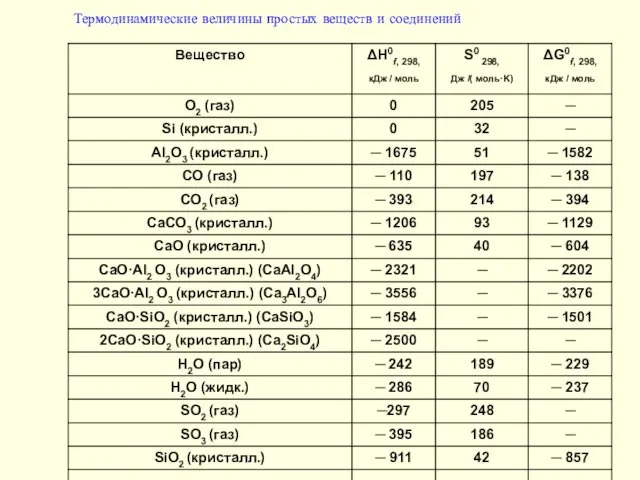
- 8. Термодинамические величины простых веществ и соединений
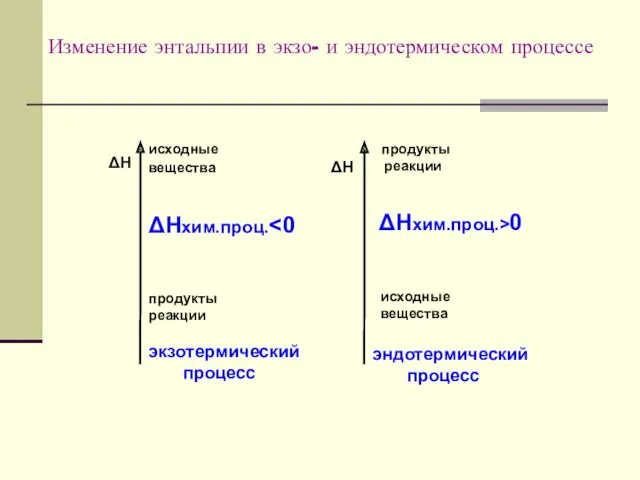
- 9. Изменение энтальпии в экзо- и эндотермическом процессе
- 10. Закон Г.И. Гесса и его следствие Тепловой эффект химических реакций, протекающих при V,Т─const или Р,Т─const, не
- 11. Задача. Вычислить тепловой эффект реакции образования двухкальциевого силиката ( 2СаО∙SiO2 ) из соответствующих оксидов. Решение. 2
- 12. Направленность химических процессов Литература: Коровин Н.В. Общая химия. ─ М.: Высш. шк., 2000. ─ 558 с.
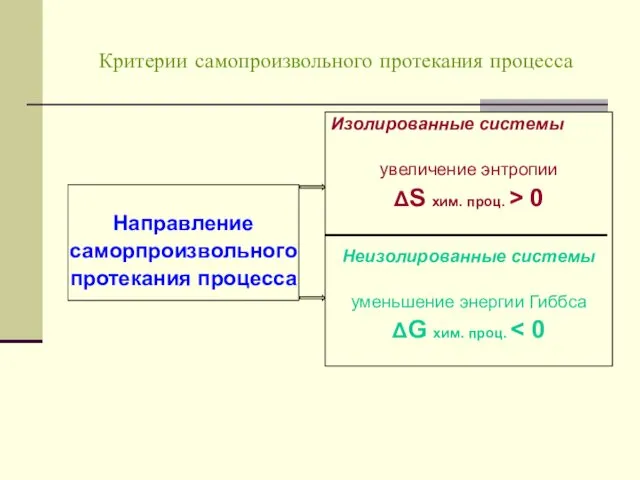
- 13. Критерии самопроизвольного протекания процесса Направление саморпроизвольного протекания процесса Изолированные системы увеличение энтропии ΔS хим. проц. >
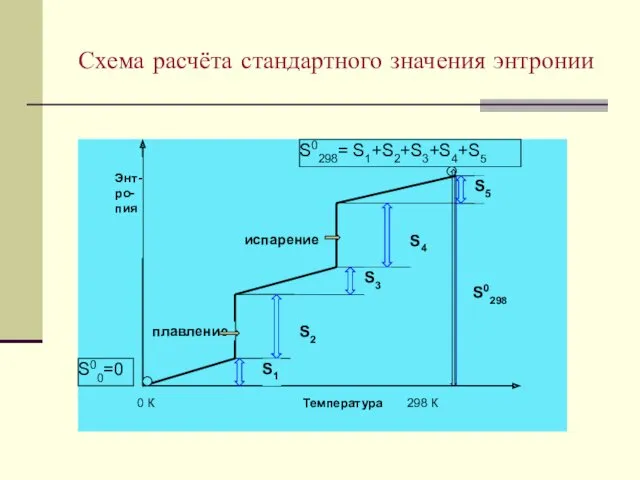
- 14. Схема расчёта стандартного значения энтронии S0298
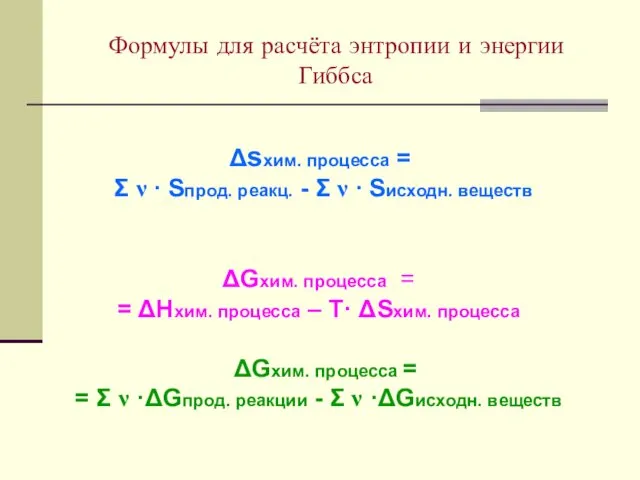
- 15. Формулы для расчёта энтропии и энергии Гиббса Δsхим. процесса = Σ ν ∙ Sпрод. реакц. -
- 16. Химическая кинетика Литература: Коровин Н.В. Общая химия. ─ М.: Высш. шк., 2000. ─ 558 с. §§
- 17. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства Гомогенная реакция
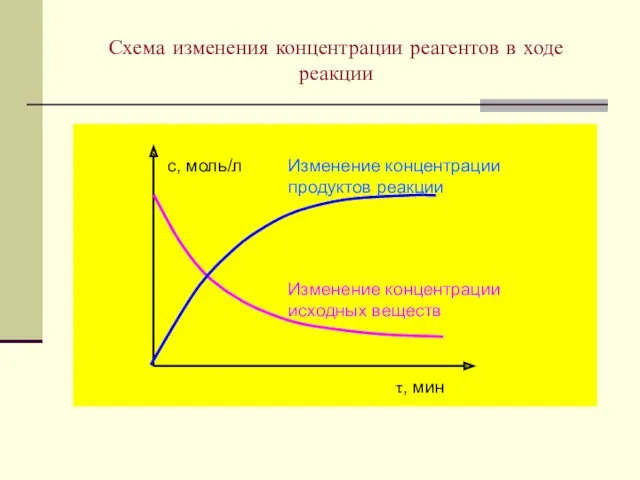
- 18. Схема изменения концентрации реагентов в ходе реакции
- 19. Методы управления скоростью реакции природа реагирующих веществ; температура; концентрация реагирующих веществ; давление (если в реакции участвуют
- 20. Влияние концентрации реагирующих веществ Скорость необратимой реакции аА + bB → dD + eE υ =
- 21. Закон действующих масс для химической кинетики При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих
- 22. Задача. Как изменится скорость сгорания метана СН4(г) + 2 О2(г) → СО2(г) + 2 Н2О(г), если
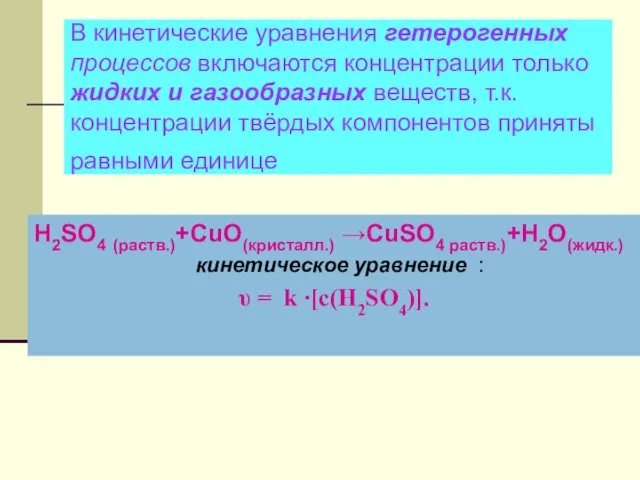
- 23. В кинетические уравнения гетерогенных процессов включаются концентрации только жидких и газообразных веществ, т.к. концентрации твёрдых компонентов
- 24. Правило Вант-Гоффа При изменении температуры на каждые 10 градусов скорость химической реакции изменяется в (2-4) раза
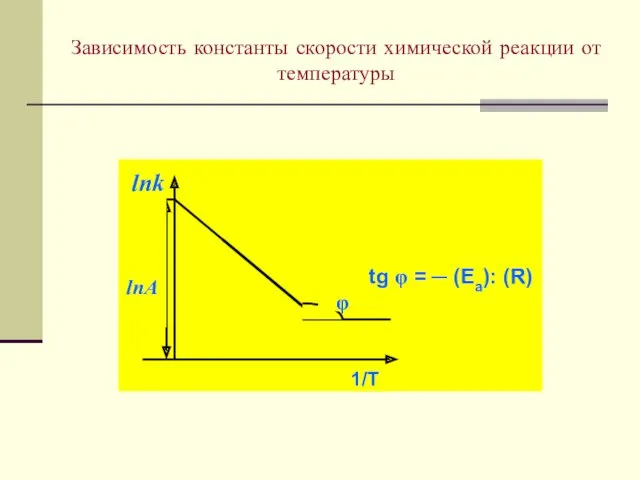
- 25. Уравнение Аррениуса где k ─ констана скорости реакции; lnA ─ постоянная; Еа ─ энергия активации; R
- 26. Зависимость константы скорости химической реакции от температуры
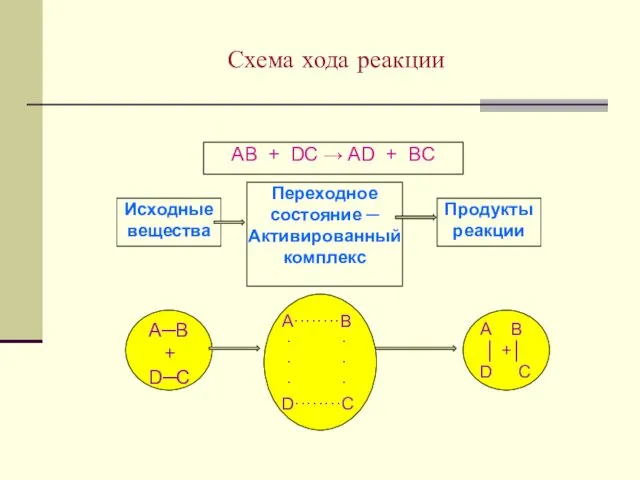
- 27. Схема хода реакции
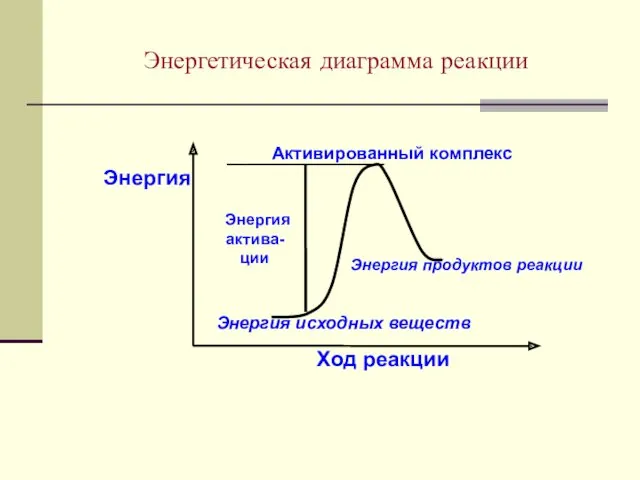
- 28. Энергетическая диаграмма реакции
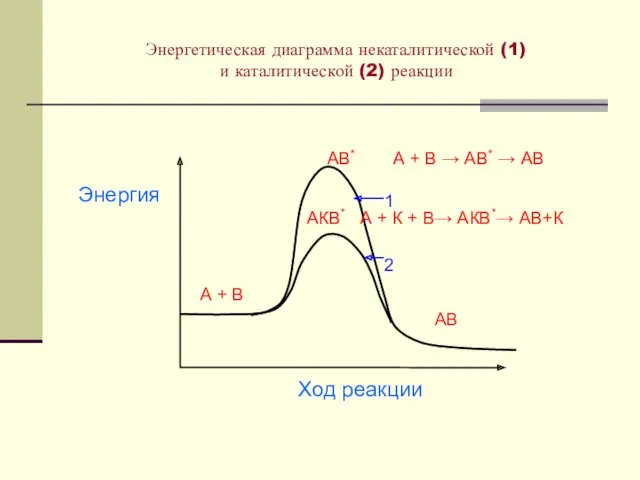
- 29. Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
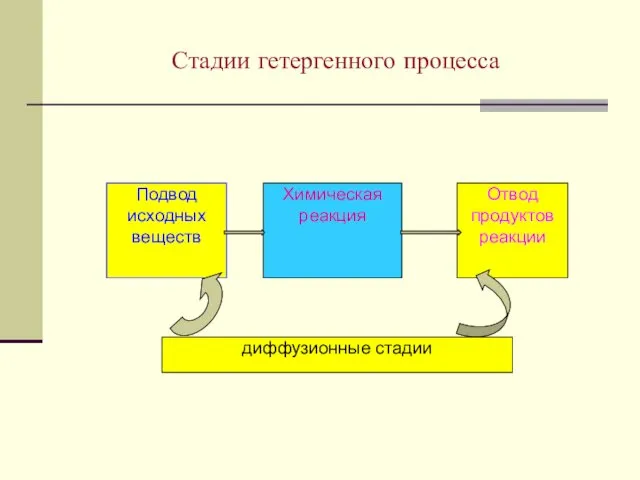
- 30. Стадии гетергенного процесса
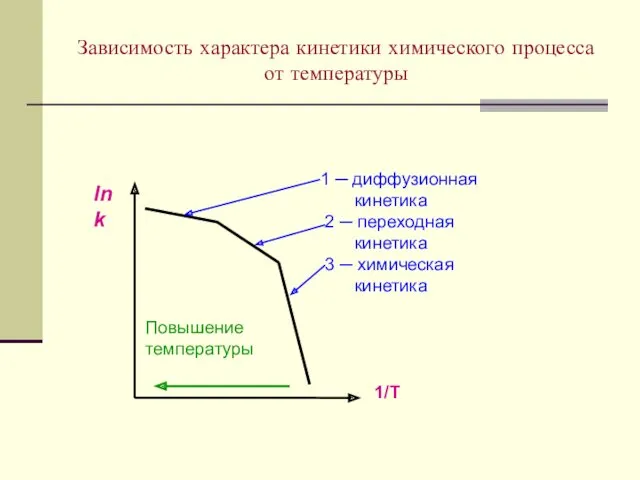
- 31. Зависимость характера кинетики химического процесса от температуры
- 32. Химическое равновесие Литература: Коровин Н.В. Общая химия. ─ М.: Высш. шк., 2000. ─ 558 с. §
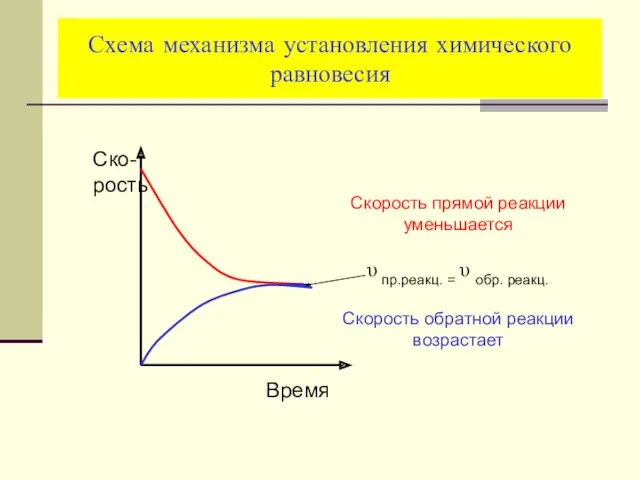
- 33. Схема механизма установления химического равновесия
- 34. Вывод выражения закона действующих масс (константы химического равновесия) Н2 (газ) + J2 (газ) 2HJ (газ) υ
- 35. Смещение равновесия. Принцип Ле Шателье Переход системы из одного состояния рвновесия в другое под влиянием изменения
- 36. Каким изменением внешних условий можно повысить полноту сгорания угля? 2С (кр.) + О2 (газ) 2СО (газ)
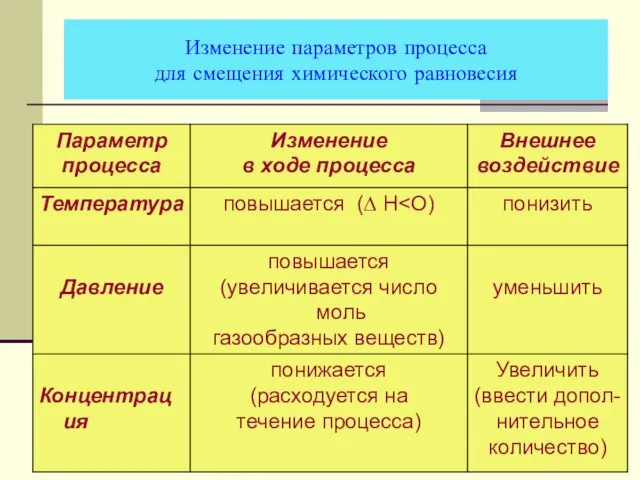
- 37. Изменение параметров процесса для смещения химического равновесия
- 39. Скачать презентацию



















 Своя игра. Латынь
Своя игра. Латынь Пертес ауруының емі. Мешел және мешел тәрізді аурулар. Сүйектегі диспластикалық үрдістері
Пертес ауруының емі. Мешел және мешел тәрізді аурулар. Сүйектегі диспластикалық үрдістері 20240124_izo_7_klass._tema_6._bukva_-_izobrazitelnyy_element_kompozitsii
20240124_izo_7_klass._tema_6._bukva_-_izobrazitelnyy_element_kompozitsii Горные породы, минералы и полезные ископаемые
Горные породы, минералы и полезные ископаемые Изменение имён прилагательных по падежам
Изменение имён прилагательных по падежам Международное движение рабочей силы
Международное движение рабочей силы Картофельные продукты
Картофельные продукты Анатомо-физиологические особенности органов и систем в различные периоды детства. Часть 2
Анатомо-физиологические особенности органов и систем в различные периоды детства. Часть 2 Проект Зимушка-зима
Проект Зимушка-зима PJSC Lukoil
PJSC Lukoil Юпитер отец Земли
Юпитер отец Земли Техническое обслуживание аппаратуры управления электромагнитного типа. Судовые нагревательные приборы. (Билет 27)
Техническое обслуживание аппаратуры управления электромагнитного типа. Судовые нагревательные приборы. (Билет 27) Планирование производственной программы. Тема 4
Планирование производственной программы. Тема 4 Майский праздник - День Победы
Майский праздник - День Победы Решение задач по теме Исследование функции с помощью производной
Решение задач по теме Исследование функции с помощью производной Фонтанная эксплуатация скважин, виды фонтанирования, оборудование фонтанных скважин. НКТ, выкидные линии, регулирование режима
Фонтанная эксплуатация скважин, виды фонтанирования, оборудование фонтанных скважин. НКТ, выкидные линии, регулирование режима People's Republic of China
People's Republic of China Устройство памяти и процессора. Память ЭВМ
Устройство памяти и процессора. Память ЭВМ Охранно - пожарная сигнализация. Виды сигнализаций
Охранно - пожарная сигнализация. Виды сигнализаций Макеты, технические требования, контрольный образец. Лекция 16
Макеты, технические требования, контрольный образец. Лекция 16 Микроконтроллеры платформа Arduino UNO
Микроконтроллеры платформа Arduino UNO Памятники сказочным героям
Памятники сказочным героям Фразеология русского языка
Фразеология русского языка Взаимное пересечение поверхностей
Взаимное пересечение поверхностей Процесс пищеварения в ротовой полости
Процесс пищеварения в ротовой полости Расчет воздухообмена в помещении
Расчет воздухообмена в помещении Характеристика и особенности моделирования учебно-тренировочного занятия в игре футбол
Характеристика и особенности моделирования учебно-тренировочного занятия в игре футбол Организация воспитательного процесса в высшей школе
Организация воспитательного процесса в высшей школе