Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
- 3. Список сокращений и основных обозначений Выучить! Чупахин А. П. Химический процесс: энергетика и равновесие . Стр.
- 4. Примеры обозначений H - энтальпия A - работа с - теплоемкость ср - изобарная теплоемкость C
- 5. Изучили: Будем изучать: Строение вещества Статистическое состояние Процесс Движение
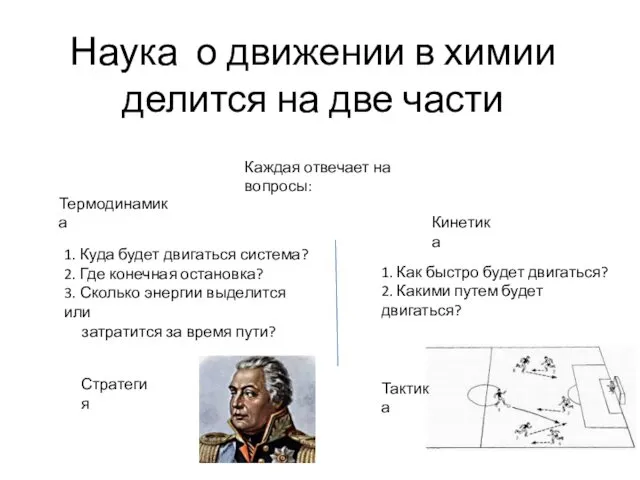
- 6. Наука о движении в химии делится на две части Термодинамика Кинетика 1. Куда будет двигаться система?
- 7. Термодинамика Отдел физики, изучающий теплоту и закономерности теплового движения. Николя́ Леона́р Сади́ Карно́ Nicolas Léonard Sadi
- 8. Химическая термодинамика рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям.
- 9. Очень много определений
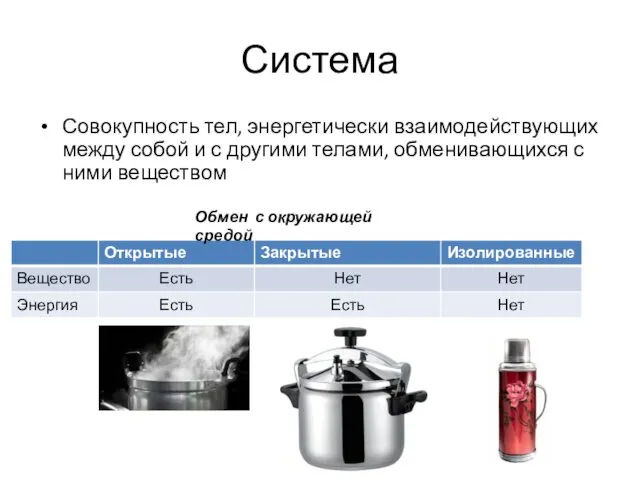
- 10. Система Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом Обмен
- 11. Система Гомогенные Гетерогенные Однородные Не однородные
- 12. Процессы Изотермические (T =const) Изохорические (V =const) Изобарические (P =const) Адиабатические (Q =const) Изолированная система
- 13. Процессы Обратимые процессы – процессы, в которых система возвращается в первоначальное состояние. Необратимые – когда система
- 14. Процессы Самопроизвольными называют такие процессы, которые протекают без внешнего воздействия, при постоянстве всех внешних условий. Равновесные
- 15. Функции Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы
- 16. Экстенсивные и интенсивные функции Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать):
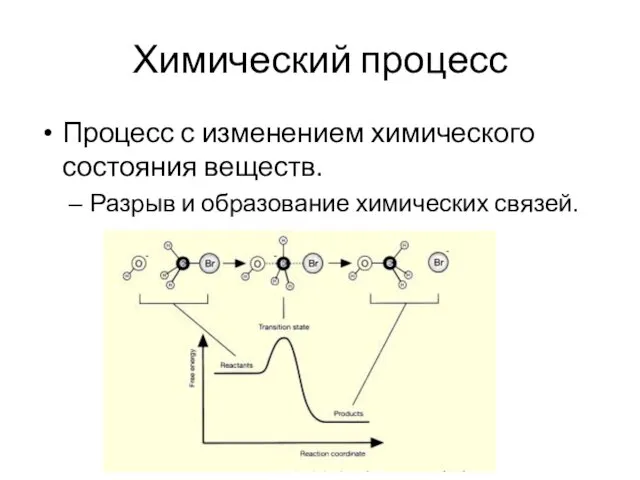
- 17. Химический процесс Процесс с изменением химического состояния веществ. Разрыв и образование химических связей.
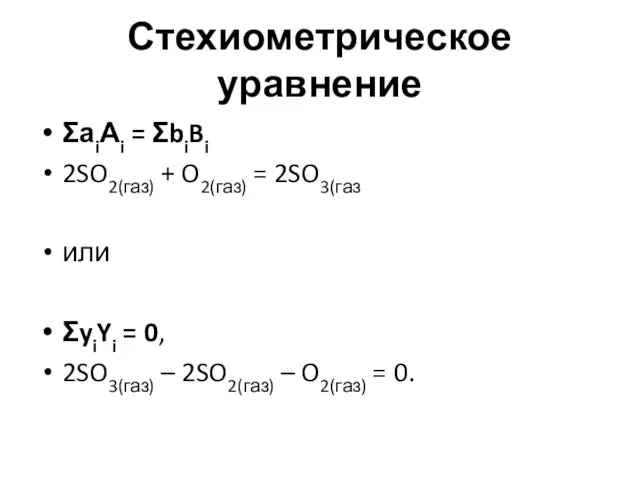
- 18. Стехиометрическое уравнение ΣаiАi = ΣbiBi 2SO2(газ) + O2(газ) = 2SO3(газ или ΣyiYi = 0, 2SO3(газ) –
- 19. Стехиометрическое уравнение ХП отражает фундаментальные законы природы – сохранение массы и заряда. (Закон Ломоносова–Лавуазье) 2SO2(газ) +
- 20. Энергия Энергия – форма существования материи. Мера движения и взаимодействия материи. Кинетическая и потенциальная. Потенциалы: Гравитационный
- 21. Энергия системы Тепловое движение Энергия химических и межмолекулярных связей (электромагнитное взаимодействие) Фактор упорядочения Концентрации частиц
- 22. Тепловая энергия RТ в расчёте на моль – kТ на молекулу R = NA · k
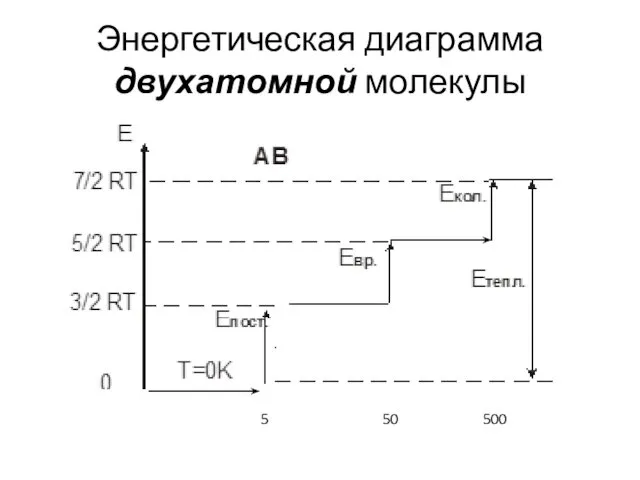
- 23. Энергетическая диаграмма двухатомной молекулы 5 50 500
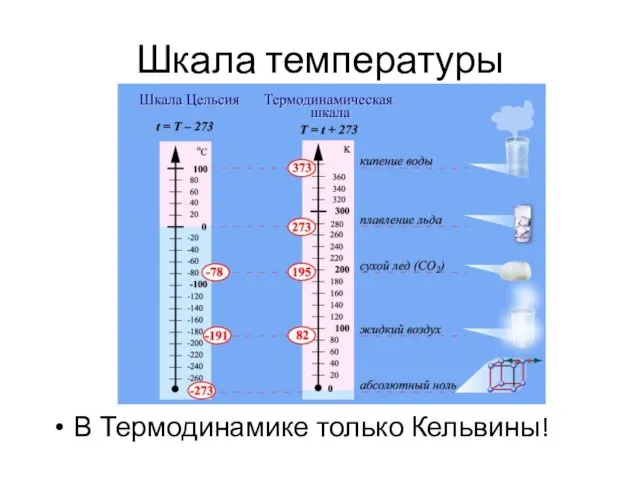
- 24. Шкала температуры В Термодинамике только Кельвины!
- 25. Теплоемкость Теплоёмкость с – это количество теплоты δQ, поглощаемой телом при его нагревании на dТ, т.
- 26. Энергия химических связей Химический процесс – разрыв и образование химических связей. Энергия 1 моля хим. связи
- 27. Диссоциация двухатомной молекулы H2 = H + H 435,9 O2 = O + O 498,7 N2
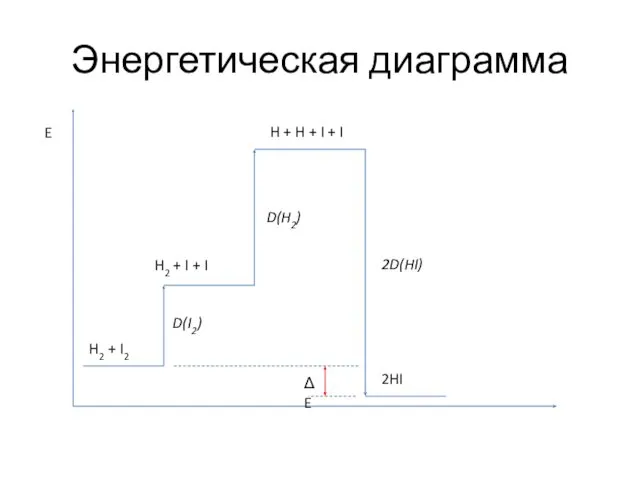
- 28. Образование иодоводорода из простых веществ H2 + I2 = 2HI Нужно разорвать две связи H—H и
- 29. Образование иодоводорода из простых веществ ΔE = -9,9 кДж/моль Отрицательное значение - энергия выделяется. Экзотермичная реакция.
- 30. Энергетическая диаграмма H2 + I2 2HI H2 + I + I H + H + I
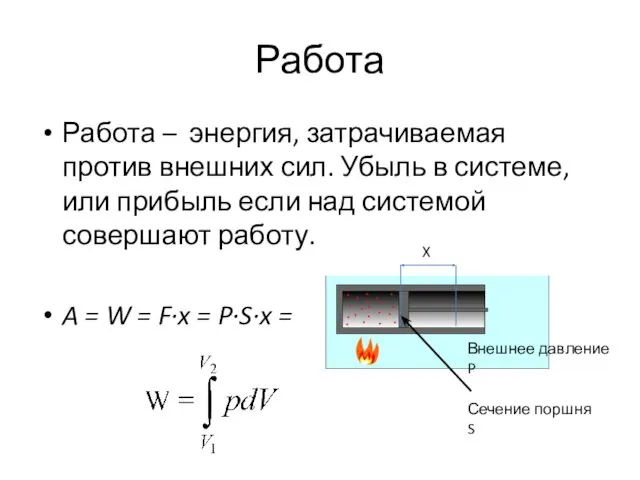
- 31. Работа Работа – энергия, затрачиваемая против внешних сил. Убыль в системе, или прибыль если над системой
- 32. 1 начало термодинамики ΔU = Q – W, dU = δQ – δW Закон сохранения энергии
- 33. Изменение теплоты при изохорном процессе ΔQv = ΔU + W Так как ΔV = 0, P·ΔV
- 34. PV = nRT Закон Ломоносова-Клапейрона Размерность PV и nRT – Джоуль. К этому уравнению вернемся позже.
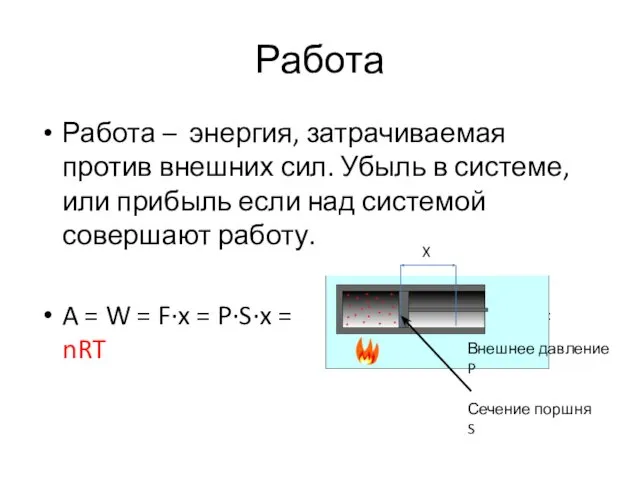
- 35. Работа Работа – энергия, затрачиваемая против внешних сил. Убыль в системе, или прибыль если над системой
- 36. Изменение теплоты при изохорном процессе ΔQp = ΔU + W W = PΔV = RT ΔQp
- 37. Энтальпия H Энтальпи́я — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве
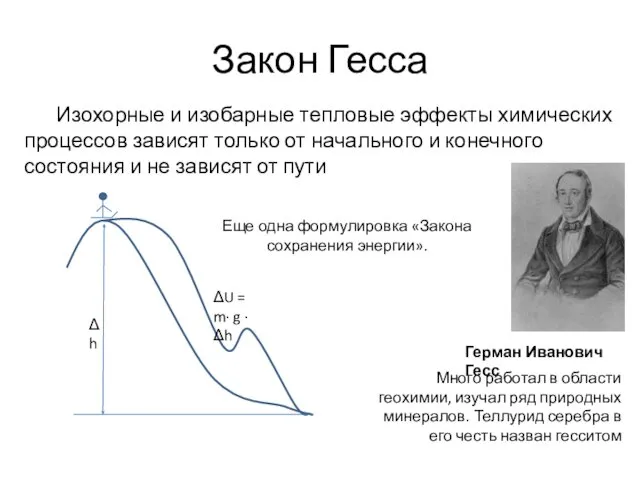
- 38. Закон Гесса Герман Иванович Гесс Много работал в области геохимии, изучал ряд природных минералов. Теллурид серебра
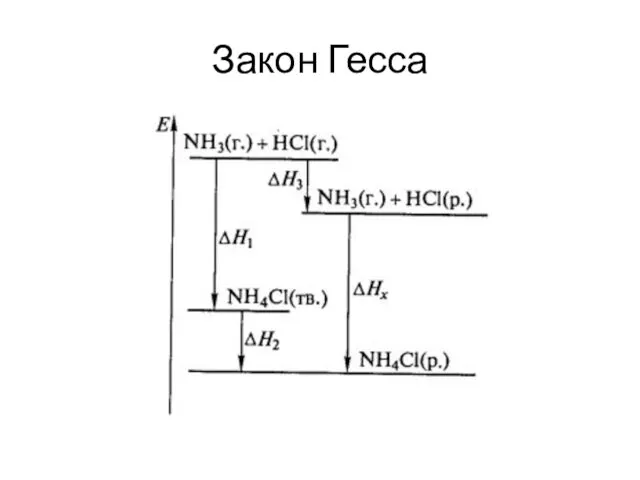
- 39. Закон Гесса
- 41. Скачать презентацию
























 Ivan Ivanovich Shishkin
Ivan Ivanovich Shishkin Classic vs Modern 1
Classic vs Modern 1 дистант по географии 7 класс
дистант по географии 7 класс Типы алгоритмов. Что такое алгоритм?
Типы алгоритмов. Что такое алгоритм? Кремний - важнейший элемент жизни
Кремний - важнейший элемент жизни Исследовательская работа Я на радугу-дугу полюбуюсь, побегу!
Исследовательская работа Я на радугу-дугу полюбуюсь, побегу! Проверка и испытание кабельных линий электропередач
Проверка и испытание кабельных линий электропередач Пасха. История пасхи
Пасха. История пасхи Движение воздушных масс. Атмосферный фронт. Циклоны и антициклоны
Движение воздушных масс. Атмосферный фронт. Циклоны и антициклоны Исследования России. Интерактивный тест
Исследования России. Интерактивный тест Презентация к уроку технологии по теме: Осень
Презентация к уроку технологии по теме: Осень Буровые растворы
Буровые растворы Исследовательский проект как средство активизации познавательной деятельности учащихся
Исследовательский проект как средство активизации познавательной деятельности учащихся Фрезерование. Обработка торцевых канавок
Фрезерование. Обработка торцевых канавок Diplom
Diplom Социализация дошкольника. Игра как форма социализации дошкольника
Социализация дошкольника. Игра как форма социализации дошкольника Метеостанція на базі модуля ESP32 та Arduino Micro Pro з бездротовим зв'язком та підтримкою ОС Windows та Android
Метеостанція на базі модуля ESP32 та Arduino Micro Pro з бездротовим зв'язком та підтримкою ОС Windows та Android Презентация к занятию по краеведению (Пермский край) Чердынь - древняя столица Прикамья
Презентация к занятию по краеведению (Пермский край) Чердынь - древняя столица Прикамья Устройство, назначение и принцип работы силовых трансформаторов
Устройство, назначение и принцип работы силовых трансформаторов Снаряжение для пешеходного туризма. (Тема 2)
Снаряжение для пешеходного туризма. (Тема 2)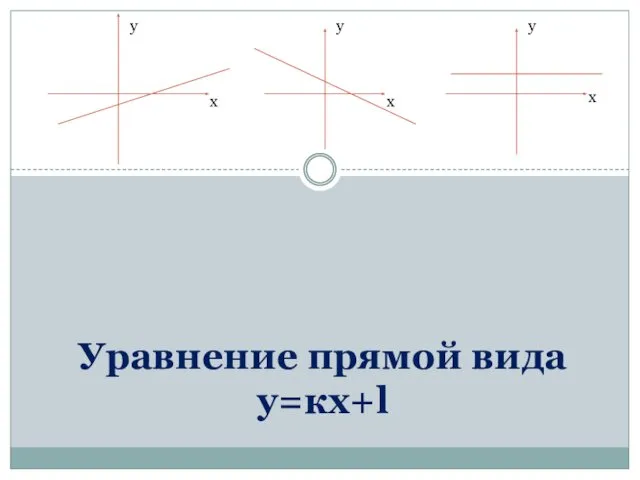 Уравнение прямой вида у=кх+l
Уравнение прямой вида у=кх+l Михаил Васильевич Ломоносов
Михаил Васильевич Ломоносов Проект благоустройства общественного пространства Толстовский бульвар
Проект благоустройства общественного пространства Толстовский бульвар Книги - юбиляры 2020 года для младшего возраста
Книги - юбиляры 2020 года для младшего возраста Последние корректировки для дистрибьютеров Прима Дистрибьюшн
Последние корректировки для дистрибьютеров Прима Дистрибьюшн Метрология
Метрология Кожухотрубные теплообменные аппараты
Кожухотрубные теплообменные аппараты Декоративно-прикладное искусство. 5 класс
Декоративно-прикладное искусство. 5 класс