Содержание
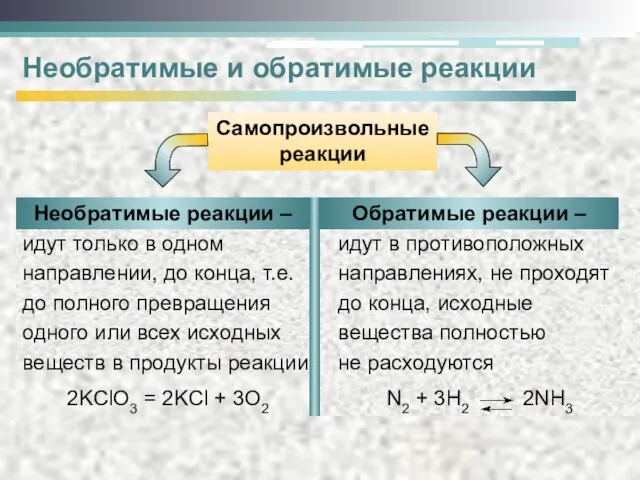
- 2. Cамопроизвольные реакции Необратимые и обратимые реакции идут только в одном направлении, до конца, т.е. до полного
- 3. Химическое равновесие Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия В
- 4. В закрытой системе в состоянии равновесия при постоянных температуре и давлении отношение произведений концентраций продуктов реакции
- 5. Гомогенная система N2(г) + 3H2(г) 2NH3(г) Для реакций, протекающих в газовой Выражение константы фазе, константу равновесия
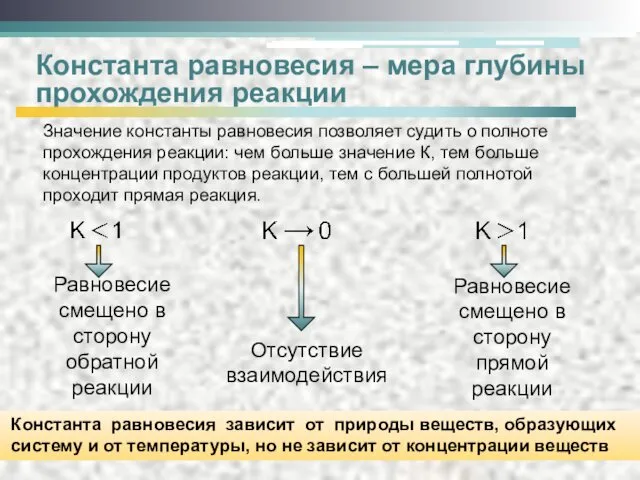
- 6. Константа равновесия – мера глубины прохождения реакции Отсутствие взаимодействия Равновесие смещено в сторону прямой реакции Равновесие
- 7. Влияние различных факторов на состояние химического равновесия.Принцип Ле Шателье Если на систему, находящуюся в равновесии, оказать
- 8. Влияние концентраций веществ на состояние равновесия системы CH4(г) + 2H2O(г) CO2(г) + 4H2(г) Внешнее воздействие Смещение
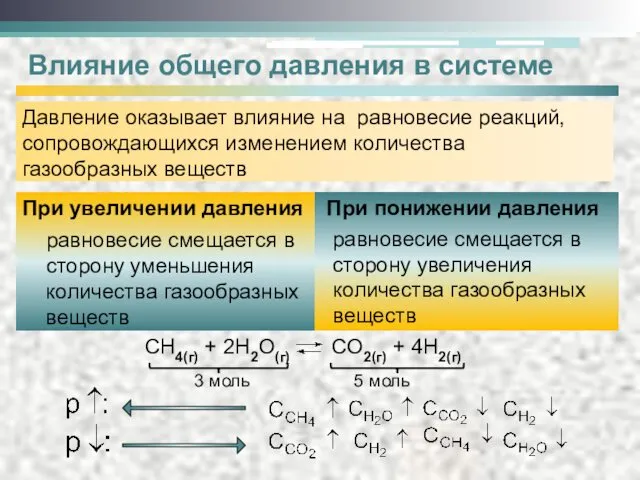
- 9. Влияние общего давления в системе Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количества газообразных веществ
- 11. Скачать презентацию





 Призентация к общешкольному мероприятию 9 Мая- День Победы
Призентация к общешкольному мероприятию 9 Мая- День Победы Сложные предложения с разными видами связи
Сложные предложения с разными видами связи Соотношения между сторонами и углами треугольника
Соотношения между сторонами и углами треугольника Модный образ на основе современного направления моды и модных трендов от WELLA
Модный образ на основе современного направления моды и модных трендов от WELLA Открытые горные работы
Открытые горные работы Альбом. Герои комедии ,,Ревизор”
Альбом. Герои комедии ,,Ревизор” Соотношения между сторонами и углами прямоугольного треугольника
Соотношения между сторонами и углами прямоугольного треугольника Памятники и архитектурные сооружения города Омска
Памятники и архитектурные сооружения города Омска Ультразвуковая диагностика гепатопанкреатобилиарной системы (ГПБС)
Ультразвуковая диагностика гепатопанкреатобилиарной системы (ГПБС) Вяртсильская средняя школа
Вяртсильская средняя школа Острый аппендицит и инвагинация кишечника
Острый аппендицит и инвагинация кишечника Дін және Жастар
Дін және Жастар Уголовное право. Понятие преступления и виды преступлений
Уголовное право. Понятие преступления и виды преступлений Десять основных положений нового закона Об образовании в РФ
Десять основных положений нового закона Об образовании в РФ Основы электроники
Основы электроники Методический семинар
Методический семинар Концепция инклюзивного образования в Республике Татарстан
Концепция инклюзивного образования в Республике Татарстан Употребление слов под титлами в церковно-славянских текстах
Употребление слов под титлами в церковно-славянских текстах
 Мій комп`ютер у моєму житті
Мій комп`ютер у моєму житті Презентация проекта Театральная неделя в старшей группе
Презентация проекта Театральная неделя в старшей группе Обеспечение эмоционального благополучия в группах детского сада посредством компонентов РППС
Обеспечение эмоционального благополучия в группах детского сада посредством компонентов РППС Проблемы подготовки специалистов (не экологических направлений), ориентированных на рациональное использование биоресурсов
Проблемы подготовки специалистов (не экологических направлений), ориентированных на рациональное использование биоресурсов Проектирование и исследование. Цель по SMART. Кейс-игра
Проектирование и исследование. Цель по SMART. Кейс-игра Современный дизайн кухонь
Современный дизайн кухонь Электрические станции и подстанции. Распределительные устройства напряжением 6-220 Кв. (Лекция 4)
Электрические станции и подстанции. Распределительные устройства напряжением 6-220 Кв. (Лекция 4) Керування пристроями введення/виведення
Керування пристроями введення/виведення Презентация к уроку Европейский Север 9 класс
Презентация к уроку Европейский Север 9 класс