Содержание
- 2. Первое начало термодинамики Dнутренняя энергия U является функцией состояния, а dU -полным дифференциалом. Величины р, V,
- 3. Первое начало термодинамики где dV/dT в правой части зависит от характера процесса. Для процесса V= const
- 4. Первое начало термодинамики Cp-CV=R - уравнение Майера. U=iRT/2 CV= iR/2 Жесткие молекулы (iколеб.=0): 1-атомный газ: i
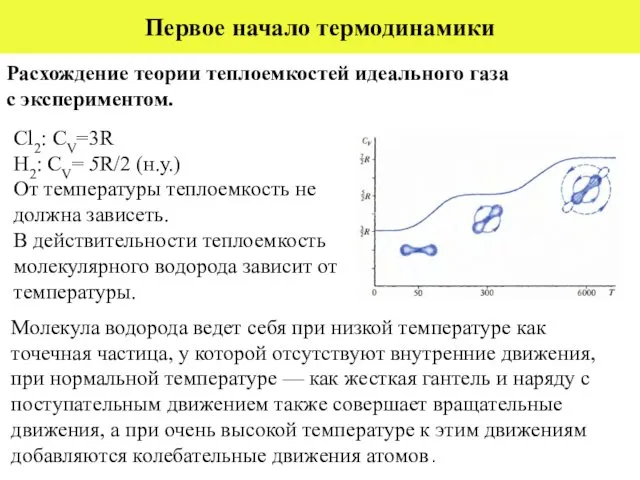
- 5. Первое начало термодинамики Cl2: CV=3R H2: CV= 5R/2 (н.у.) От температуры теплоемкость не должна зависеть. В
- 6. Расхождение теории теплоемкостей с экспериментом. Низкая температура движение молекулы водорода между столкновениями подобно поступательному движению тв.
- 7. Первое начало термодинамики Политропический процесс. Процесс, происходящий при постоянной теплоемкости. Примеры: изобарический, изохорический, изотермический и адиабатический
- 8. Первое начало термодинамики Изохорический процесс: V= const. Изотермический процесс: T= const. Т— const и dU =
- 9. Первое начало термодинамики Адиабатический процесс: δQ=0. CVdT+pdV=0. Уравнение адиабаты — равенство, связывающее параметры в адиабатическом процессе
- 10. Первое начало термодинамики Адиабатический процесс γ = (i + 2)/i. Для одноатомных газов i = 3
- 11. Первое начало термодинамики Уравнение политропы. Из требования, чтобы теплоемкость С была постоянной в процессе, следует, что
- 12. Первое начало термодинамики Энтропия идеального газа. δQ/T=CVdT/T+pdV/T Физический смысл энтропии. T=const dS=RdlnV
- 13. Первое начало термодинамики Энтропия идеального газа. число пространственных микросостояний частиц 1-го моля газа:
- 14. Первое начало термодинамики Энтропия идеального газа. Энтропия S определяется логарифмом числа микросостояний, посредством которых реализуется рассматриваемое
- 15. Первое начало термодинамики Энтропия идеального газа. Изменение энтропии в процессах идеального газа проводится по формуле
- 17. Скачать презентацию













 Движущие силы эволюции. Борьба за существование
Движущие силы эволюции. Борьба за существование Мой знак зодиака
Мой знак зодиака Технология каменной кладки
Технология каменной кладки Дмитрий Донской
Дмитрий Донской Презентация для педагогов дошкольных образовательных учреждений: Безопасность и здоровье детей дошкольного возраста.
Презентация для педагогов дошкольных образовательных учреждений: Безопасность и здоровье детей дошкольного возраста. Мультиплікатор: сутність, причини виникнення і наслідки для економіки
Мультиплікатор: сутність, причини виникнення і наслідки для економіки Простое слово - извините
Простое слово - извините Прокат спорт товаров
Прокат спорт товаров Глоссарий. Информационное право
Глоссарий. Информационное право Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3)
Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3) Требования к оформлению реквизитов организационно-распорядительных документов
Требования к оформлению реквизитов организационно-распорядительных документов Гармония. Адаптивная физическая культура
Гармония. Адаптивная физическая культура Конструирование одежды
Конструирование одежды Топографическая анатомия в области предплечья и кисти. (Занятие 3)
Топографическая анатомия в области предплечья и кисти. (Занятие 3) Электронное портфолио к конкурсу Учитель года 2013 3 часть
Электронное портфолио к конкурсу Учитель года 2013 3 часть Пример использования проматриц в задачах управления электромеханическими системами
Пример использования проматриц в задачах управления электромеханическими системами Военно-патриотический центр Русский витязь
Военно-патриотический центр Русский витязь Конфликтілердің алдын алу
Конфликтілердің алдын алу Сущность научного знания и его метод
Сущность научного знания и его метод Основные требования к студентам, проходящим производственную практику по получению профессиональных умений
Основные требования к студентам, проходящим производственную практику по получению профессиональных умений иваньков
иваньков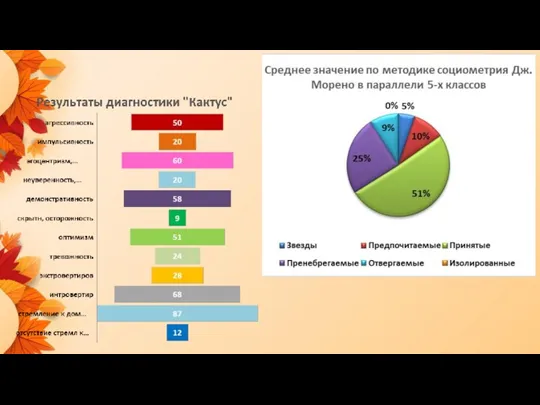 20231106_23-24_rk_5-e_po_rezultatu_dlya_sayta_chast_3
20231106_23-24_rk_5-e_po_rezultatu_dlya_sayta_chast_3 Презентация Конфликты в семье.
Презентация Конфликты в семье. Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары
Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары Если бы я была строителем .. 7 класс
Если бы я была строителем .. 7 класс Филогенез систем органов позвоночных животных
Филогенез систем органов позвоночных животных Экологические группы растений по отношению к воде
Экологические группы растений по отношению к воде Посвящение в химики
Посвящение в химики