Слайд 2

Модельная система: идеальный жидкий бинарный раствор в равновесии с собственным паром.
Растворитель («1») и растворенное вещество («2») летучи, пар над раствором содержит оба компонента и имеет свойства идеального газа.
Слайд 3

В идеальных растворах стремление к переходу в газовую фазу одинаково для
всех компонентов раствора и связано с концентрацией компонента в растворе.
Слайд 4

Если оба компонента идеального раствора летучи, то закон Рауля выполняется для
каждого из них на всем интервале концентраций, а общее давление пара над раствором равно сумме парциальных давлений компонентов. Все зависимости давление - состав линейны.
Слайд 5

Слайд 6

Предельно (бесконечно) разбавленные растворы. Закон Генри.
В предельно разбавленных растворах к растворителю
применимы законы идеальных растворов (закон Рауля), а для растворенного вещества справедлив закон Генри.
Парциальное давление пара растворенного вещества над бесконечно разбавленным раствором пропорционально его мольной доле в растворе.
Слайд 7
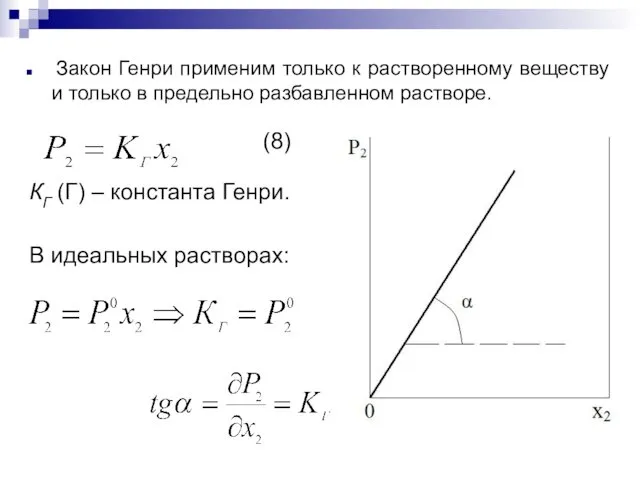
Закон Генри применим только к растворенному веществу и только в
предельно разбавленном растворе.
Слайд 8
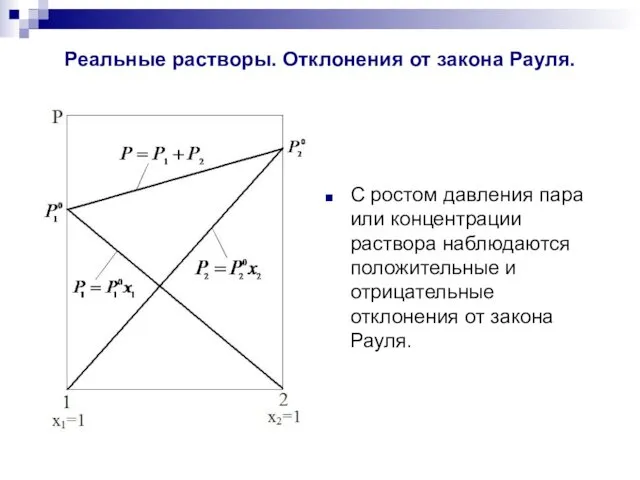
Реальные растворы. Отклонения от закона Рауля.
С ростом давления пара или концентрации
раствора наблюдаются положительные и отрицательные отклонения от закона Рауля.
Слайд 9
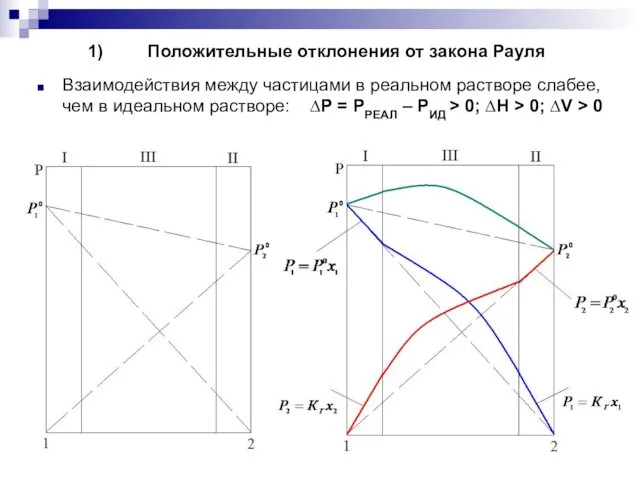
Положительные отклонения от закона Рауля
Взаимодействия между частицами в реальном растворе слабее,
чем в идеальном растворе: ∆Р = РРЕАЛ – РИД > 0; ∆H > 0; ∆V > 0
Слайд 10
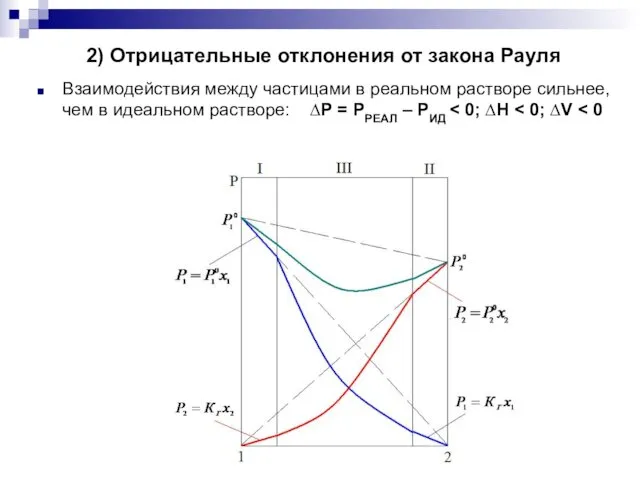
2) Отрицательные отклонения от закона Рауля
Взаимодействия между частицами в реальном растворе
сильнее, чем в идеальном растворе: ∆Р = РРЕАЛ – РИД < 0; ∆H < 0; ∆V < 0
Слайд 11

Термодинамика реальных растворов.
Активность и коэффициент активности
Для описания свойств реальных систем Льюис
ввел в термодинамику растворов понятие активности i-того компонента для конденсированных растворов и фугитивности или летучести для газовых растворов.
Слайд 12

Активность (аi) – эффективная или реально действующая концентрация компонента в растворе
Фугитивность
(fi) – эффективное давление пара
коэффициент активности (фугитивности); является поправочным коэффициентом, учитывающим различие в межмолекулярных взаимодействиях для молекул разной природы.
В идеальном растворе
- положительные отклонения от закона Рауля
- отрицательные отклонения от закона Рауля
Слайд 13

Активность – гипотетическая величина, которая при подстановке вместо концентрации в уравнения
для идеальных растворов позволяет использовать их для описания реальных растворов и получать сопоставимые результаты эксперимента и расчета.












 презентация Пустыни
презентация Пустыни Как нарисовать синицу
Как нарисовать синицу Актуальные вопросы профилактики, диагностики коронавирусной инфекции COVID-19
Актуальные вопросы профилактики, диагностики коронавирусной инфекции COVID-19 Рак шейки матки
Рак шейки матки Воспитательная работа
Воспитательная работа перелыгина
перелыгина Вены туловища
Вены туловища Способы образования глаголов
Способы образования глаголов Михаил Афанасьевич Булгаков Мастер и Маргарита, Собачье Сердце
Михаил Афанасьевич Булгаков Мастер и Маргарита, Собачье Сердце Клиникалық басқару жүйесіндегі жағдайлық көзқарас
Клиникалық басқару жүйесіндегі жағдайлық көзқарас Технология совместного (коллективного) планирования жизнедеятельности в классе
Технология совместного (коллективного) планирования жизнедеятельности в классе Концевые эффекты и их значение при измерениях фильтрационных характеристик
Концевые эффекты и их значение при измерениях фильтрационных характеристик О известном пермяке. Николай Славянов
О известном пермяке. Николай Славянов Техника безопасности при дуговой сварке
Техника безопасности при дуговой сварке Методическая разработка. Типы химических реакций.
Методическая разработка. Типы химических реакций. Аңыз әңгімелер
Аңыз әңгімелер разработки уроков
разработки уроков To be (negative: singular and plural; questions and short answers)
To be (negative: singular and plural; questions and short answers) Оранжевый цвет. Уроки тетушки Совы
Оранжевый цвет. Уроки тетушки Совы Инновационный процесс – как процесс коммерциализации новых идей. Модель ТАМО, инновационная активность бизнеса
Инновационный процесс – как процесс коммерциализации новых идей. Модель ТАМО, инновационная активность бизнеса Электронные деньги. Общее представление
Электронные деньги. Общее представление Конус. Виды конусов
Конус. Виды конусов Большая история маленькой пуговицы
Большая история маленькой пуговицы Патогенез туберкулеза. Иммунитет и аллергия. Основы иммунодиагностики туберкулезной инфекции. Лекция 2
Патогенез туберкулеза. Иммунитет и аллергия. Основы иммунодиагностики туберкулезной инфекции. Лекция 2 Субсидии и ВТО
Субсидии и ВТО Команда развития грихастха-ашрама
Команда развития грихастха-ашрама Оноре де Бальзак
Оноре де Бальзак Балашиха - презентация
Балашиха - презентация