Содержание
- 2. Мы изучаем изменение числа электронов на внешнем энергетическом уровне атомов химических элементов.
- 3. План урока 1) Понятие об ионах. Химическая связь. 2) Схема образования ионной химической связи. 3) Примеры
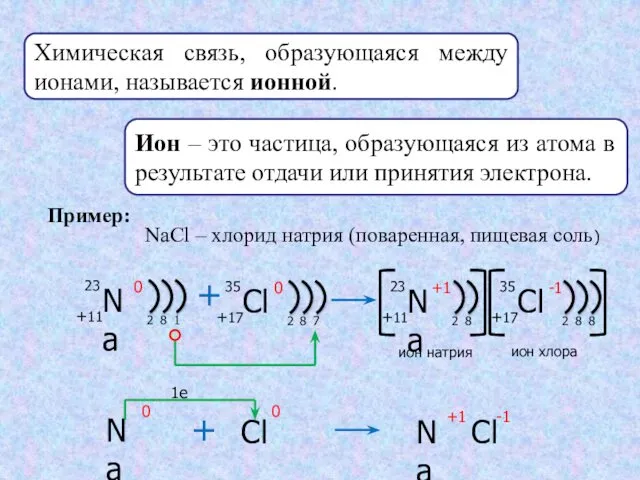
- 4. Химическая связь, образующаяся между ионами, называется ионной. Ион – это частица, образующаяся из атома в результате
- 5. Алгоритм записи схемы образования ионной связи. 1.Составить схему строения и электронные формулы атомов химических элементов, образующих
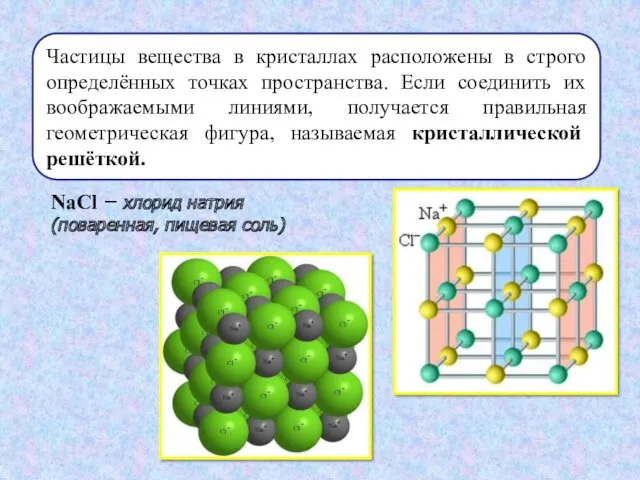
- 6. Частицы вещества в кристаллах расположены в строго определённых точках пространства. Если соединить их воображаемыми линиями, получается
- 7. Хлорид натрия – вещество с ионной кристаллической решёткой. Такие соединения представляют собой твёрдые, прочные, но обладающие
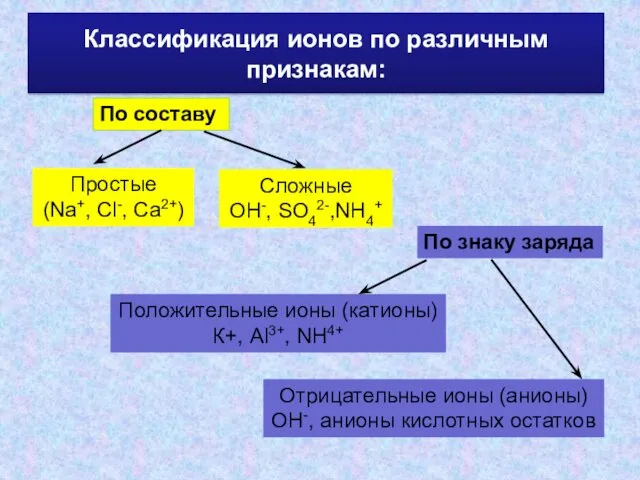
- 8. Классификация ионов по различным признакам: По составу Простые (Na+, Cl-, Ca2+) Сложные ОН-, SO42-,NH4+ По знаку
- 10. Скачать презентацию




 Термические повреждения
Термические повреждения Тестирование - как новая форма выявления уровня освоения материала при работе с детьми, имеющими проблемы чтения и письма
Тестирование - как новая форма выявления уровня освоения материала при работе с детьми, имеющими проблемы чтения и письма Русский язык, 2 класс (подготовка к ВПР)
Русский язык, 2 класс (подготовка к ВПР) Газета Известия
Газета Известия New York is the most populous city in US
New York is the most populous city in US Тёплые и холодные цвета
Тёплые и холодные цвета 20231012_uto
20231012_uto Скажи здоровью Да!
Скажи здоровью Да! Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Власть СМИ и интересы общества
Власть СМИ и интересы общества Kurs operatora wózków jezdniowych
Kurs operatora wózków jezdniowych Профессия парикмахер
Профессия парикмахер Памятники Рязани, посвященные Великой Отечественной войне.
Памятники Рязани, посвященные Великой Отечественной войне. Презентация по патриотическому воспитанию
Презентация по патриотическому воспитанию ПРЕЗЕНТАЦИЯ ПРОЕКТА ЧТО НАМ ОСЕНЬ ПОДАРИЛА- ЧАСТЬ 4
ПРЕЗЕНТАЦИЯ ПРОЕКТА ЧТО НАМ ОСЕНЬ ПОДАРИЛА- ЧАСТЬ 4 To Learn or not to Learn? Знание - сила. Незнание - рабочая сила
To Learn or not to Learn? Знание - сила. Незнание - рабочая сила Формирование и монетизация базы в Instagram
Формирование и монетизация базы в Instagram Символы Курского края. Презентация.
Символы Курского края. Презентация. Энергосбережение в зданиях. Объемно-планировочные решения
Энергосбережение в зданиях. Объемно-планировочные решения Консультация для родителей Как организовать летний досуг с ребёнком (конкурс Воспитатель-года)
Консультация для родителей Как организовать летний досуг с ребёнком (конкурс Воспитатель-года) Україна на початку Другої світової війни
Україна на початку Другої світової війни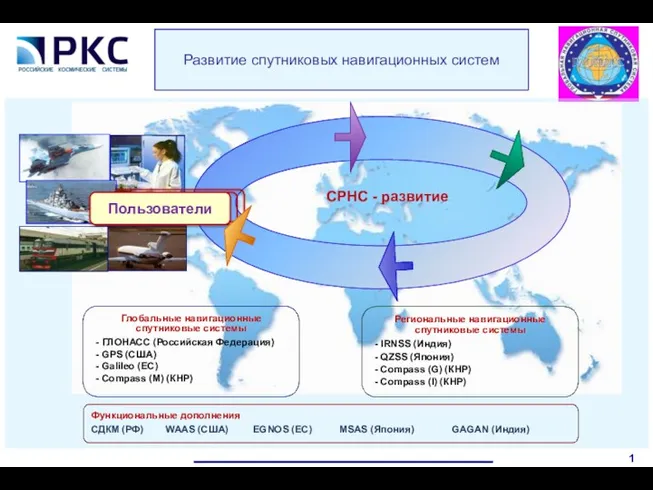 Развитие спутниковых навигационных систем СРНС
Развитие спутниковых навигационных систем СРНС Ислам. Догматика ислама
Ислам. Догматика ислама Формирование графических навыков у детей раннего возраста
Формирование графических навыков у детей раннего возраста Мозговой штурм (05)
Мозговой штурм (05) Структура страхового рынка
Структура страхового рынка Родительское собрание на тему Вызывающее поведение подростков: как реагировать и что делать?
Родительское собрание на тему Вызывающее поведение подростков: как реагировать и что делать? Медицинская реабилитация в условиях круглосуточного отделения медицинской реабилитации (2 этап)
Медицинская реабилитация в условиях круглосуточного отделения медицинской реабилитации (2 этап)