Содержание
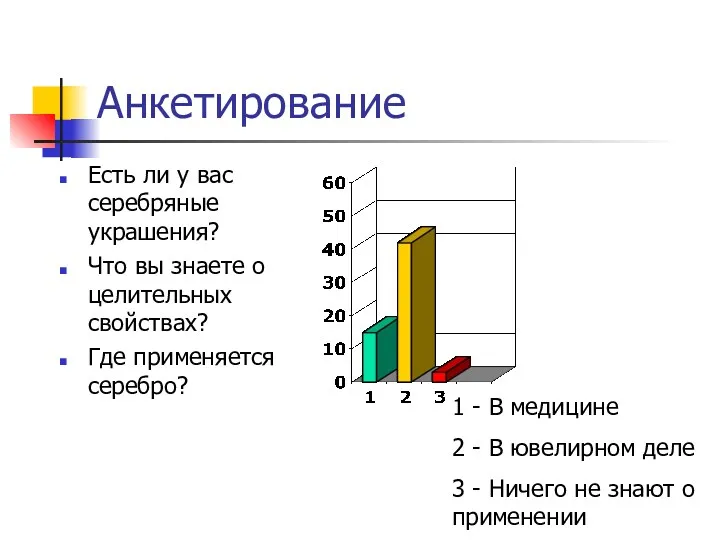
- 2. Анкетирование Есть ли у вас серебряные украшения? Что вы знаете о целительных свойствах? Где применяется серебро?
- 3. Цель - изучение серебра с точки зрения химии Задачи: Изучить по литературным источникам открытие, исторически сложившиеся
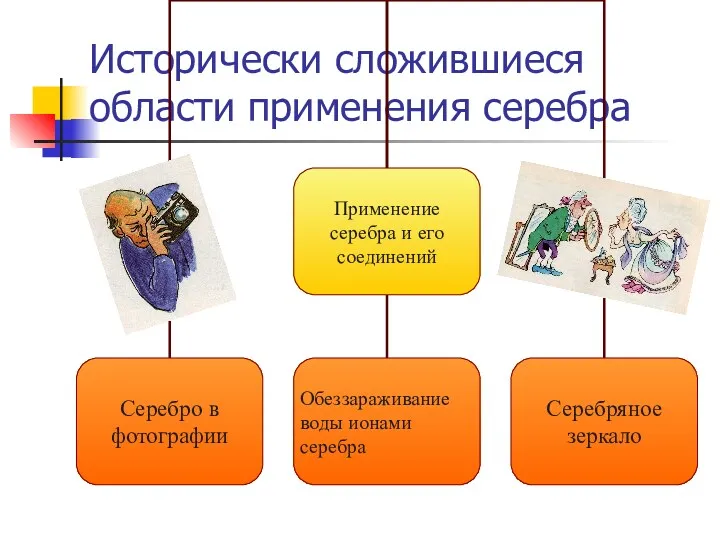
- 4. Исторически сложившиеся области применения серебра
- 5. Свойства серебра: Отличный отражатель Химическая стойкость Ковкость Высокая тепло- и электропроводность
- 6. Соединения серебра Ag2O – оксид серебра Ag2S – сульфид серебра AgCl – хлорид серебра
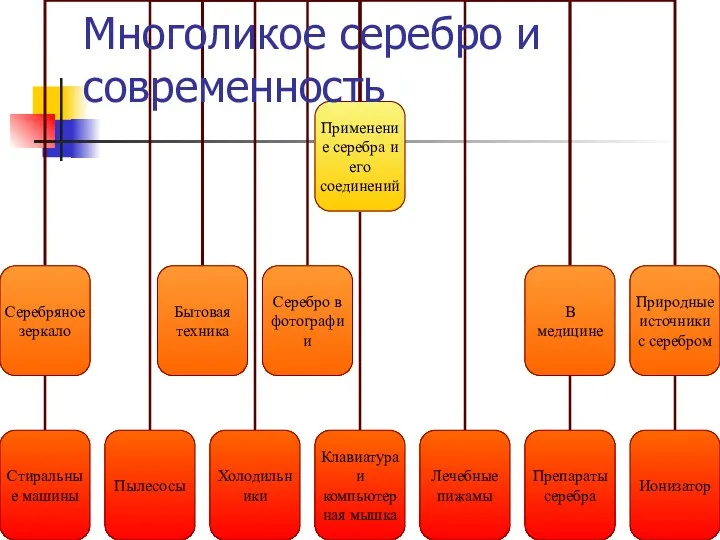
- 7. Многоликое серебро и современность
- 8. Ионы серебра в бытовой технике
- 9. Стиральные машины На этапе производства стиральной машины ее барабан изнутри покрывается наночастицами серебра, которые обеспечивают антибактериальное
- 10. Пылесосы LG KOMPRESSOR Plus - новейшая система фильтрации. Пылесборник имеет антибактериальное покрытие с ионами серебра, препятствующее
- 11. Холодильники Более качественному и длительному хранению продуктов в холодильниках Bosch KDN способствует специальное антибактериальное покрытие внутренних
- 12. Клавиатура и компьютерные мышки Антимикробное покрытие AgION испускает ионы серебра на поверхность мыши и клавиатуры, создавая
- 13. Серебряно-зависимые люди Особенно пристального внимания заслуживает выявленная группа серебряно-зависимых людей, которые формируют контингент хронических больных из-за
- 14. Лечебные пижамы Новейшее поколение одежды для больных разработано европейскими учеными. Ткань с вкраплением серебряных нитей убивает
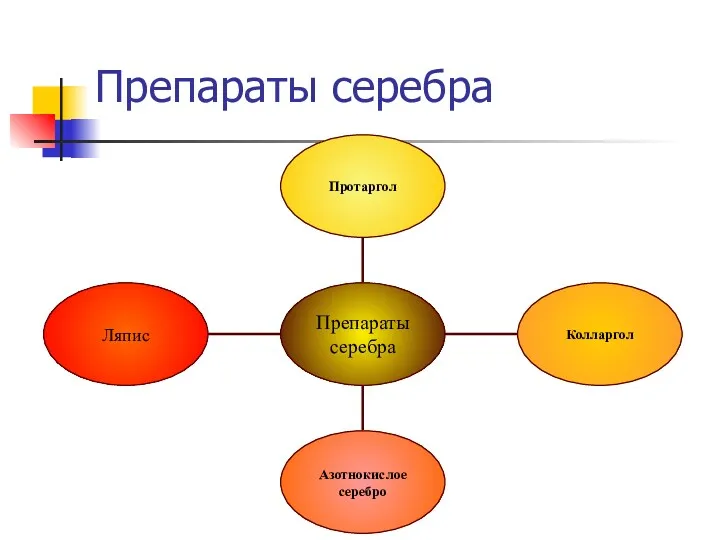
- 15. Препараты серебра
- 16. Ионизатор Получение водных растворов ионов коллоидного серебра основано на электролитическом методе - пропускании постоянного электрического тока
- 17. Природные источники воды, обогащённые серебром
- 18. Практическая часть разложение хлорида серебра Каплю соляной кислоты нанесём на фильтрованную бумагу и на пятно, образованное
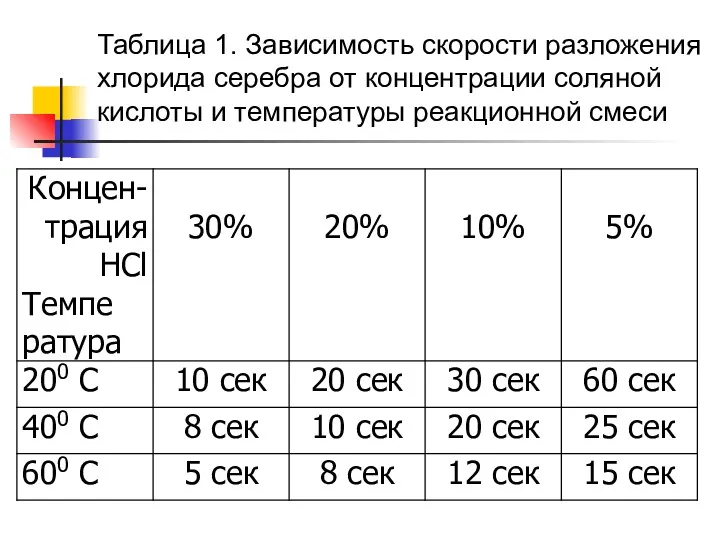
- 19. Таблица 1. Зависимость скорости разложения хлорида серебра от концентрации соляной кислоты и температуры реакционной смеси
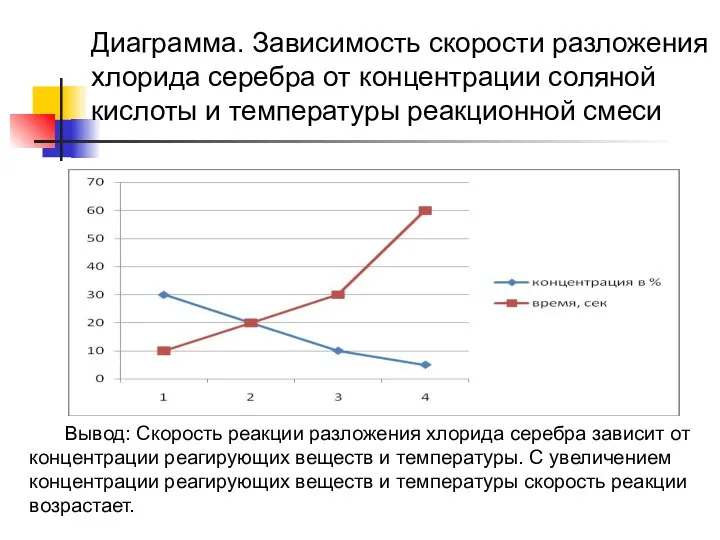
- 20. Вывод: Скорость реакции разложения хлорида серебра зависит от концентрации реагирующих веществ и температуры. С увеличением концентрации
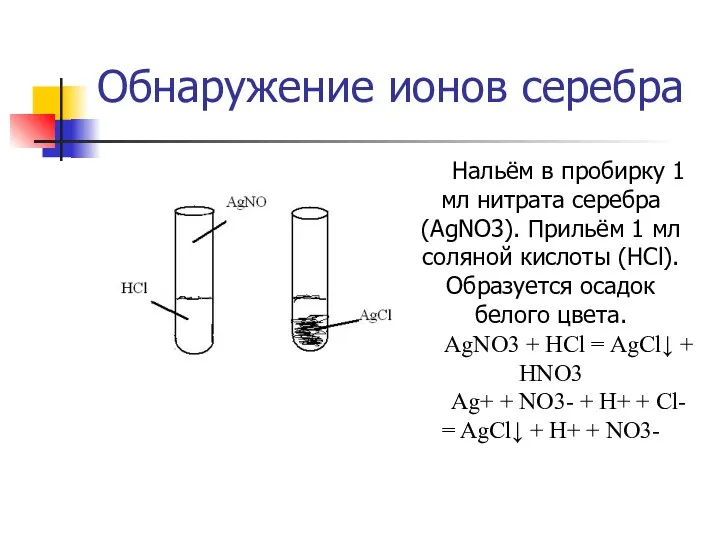
- 21. Обнаружение ионов серебра Нальём в пробирку 1 мл нитрата серебра (AgNO3). Прильём 1 мл соляной кислоты
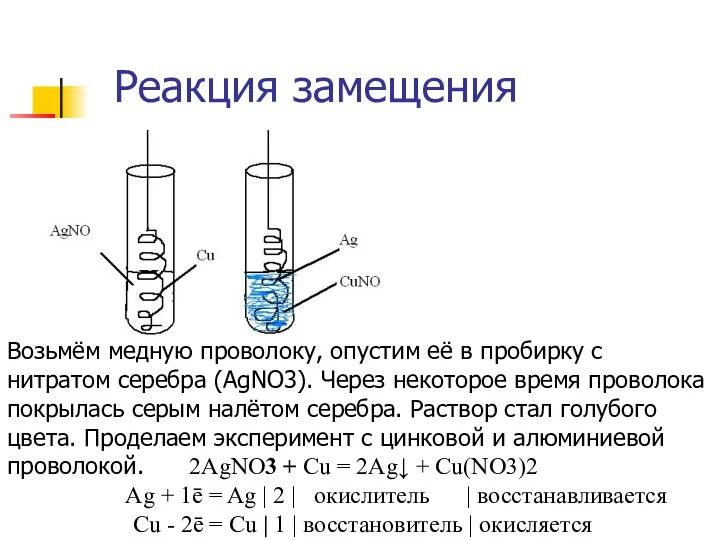
- 22. Реакция замещения Возьмём медную проволоку, опустим её в пробирку с нитратом серебра (AgNO3). Через некоторое время
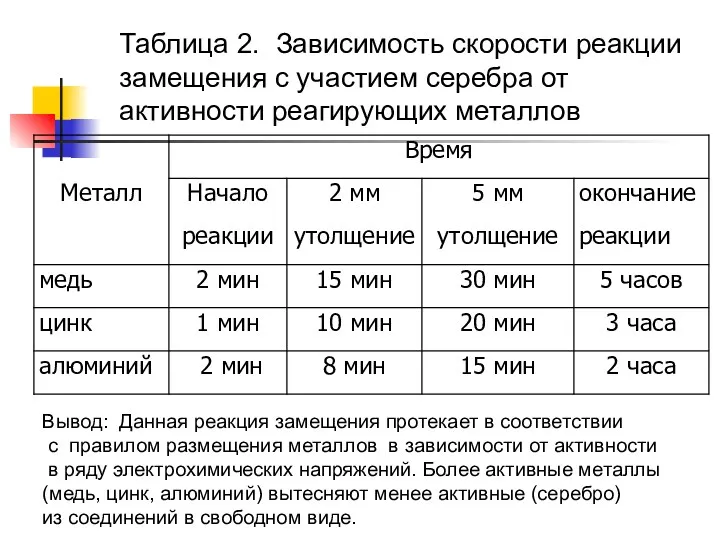
- 23. Таблица 2. Зависимость скорости реакции замещения с участием серебра от активности реагирующих металлов Вывод: Данная реакция
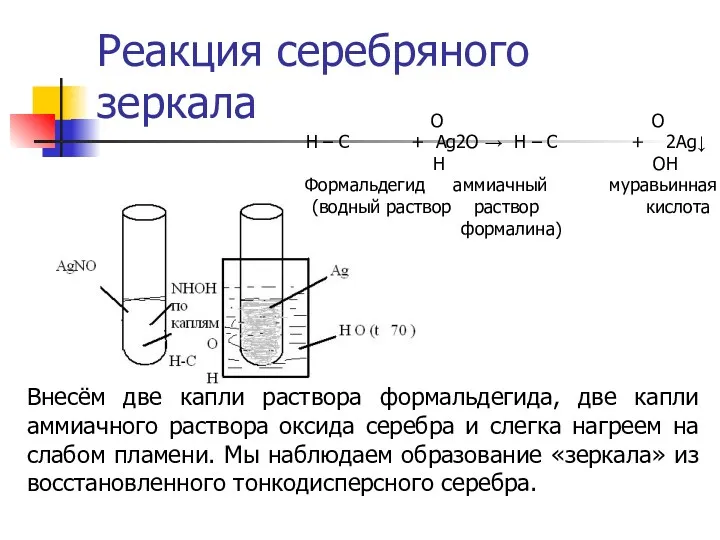
- 24. Реакция серебряного зеркала Внесём две капли раствора формальдегида, две капли аммиачного раствора оксида серебра и слегка
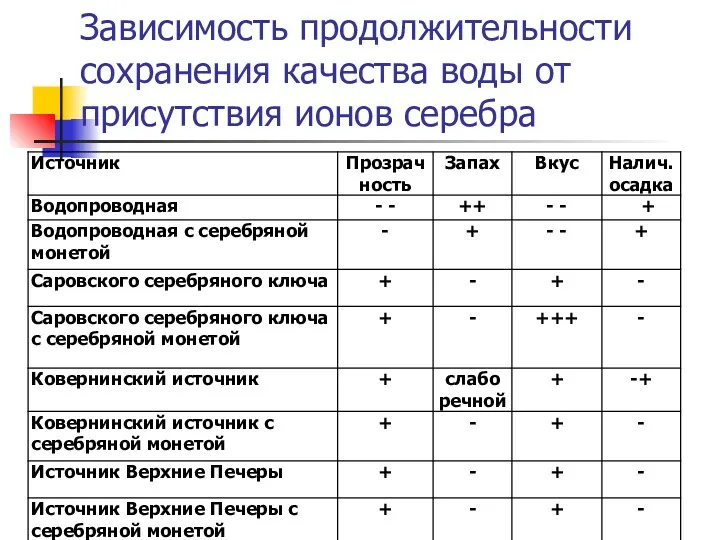
- 25. Зависимость продолжительности сохранения качества воды от присутствия ионов серебра
- 27. Скачать презентацию












 Осложнения и аварии в бурении
Осложнения и аварии в бурении Бумажная аппликация
Бумажная аппликация Синтез систем автоматического управления
Синтез систем автоматического управления Чувашская легенда
Чувашская легенда Самарская региональная общественная еврейская благотворительная организация. Курсы иврита
Самарская региональная общественная еврейская благотворительная организация. Курсы иврита Презентация по теме Работа по развитию мелкой моторики в системе здоровьесберегающих технологий
Презентация по теме Работа по развитию мелкой моторики в системе здоровьесберегающих технологий Лекарственные поражения печени
Лекарственные поражения печени Слайды
Слайды PartnerPlusBenefit - специальная бонусная программа для малых и средних предприятий
PartnerPlusBenefit - специальная бонусная программа для малых и средних предприятий Словосочетание
Словосочетание О мерах противодействия распространения ВИЧ-инфекции на территории города Вологды
О мерах противодействия распространения ВИЧ-инфекции на территории города Вологды Компьютерные игры. Советы для родителей.
Компьютерные игры. Советы для родителей. Новый год и Рождество в разных странах
Новый год и Рождество в разных странах Учение с увлечением!
Учение с увлечением! Религия в современном мире. Религиозные объединения и организации в Российской Федерации
Религия в современном мире. Религиозные объединения и организации в Российской Федерации Музыка в стиле джаз
Музыка в стиле джаз Упражнения для закрепления правильного употребления в речи предлогов.
Упражнения для закрепления правильного употребления в речи предлогов. Францияның еңбек туралы заңы
Францияның еңбек туралы заңы Презентация Какие растения самые важные
Презентация Какие растения самые важные Евреи (иудеи)
Евреи (иудеи) Инструктаж по поведению на льду
Инструктаж по поведению на льду Зачарована Десна (1956) - автобіографічна повість, спогади Олександра Довженка
Зачарована Десна (1956) - автобіографічна повість, спогади Олександра Довженка МИНИ МУЗЕЙ В ГРУППЕ РАННЕГО ВОЗРАСТА ТЕМА № 2 В ГОСТЯХ У СКАЗКИ Диск Диск
МИНИ МУЗЕЙ В ГРУППЕ РАННЕГО ВОЗРАСТА ТЕМА № 2 В ГОСТЯХ У СКАЗКИ Диск Диск Правила оформления презентации
Правила оформления презентации Борис Пастернак (1890-1960)
Борис Пастернак (1890-1960) Посвящается выпускникам 2020 года …
Посвящается выпускникам 2020 года … Телевизоры. Ключевые характеристики
Телевизоры. Ключевые характеристики Сибирская язва
Сибирская язва