Слайд 2

Са
Щëлочно - земельный металл
Элемент IIA (II группа главная подгруппа) ПС
4 период
Z
(порядковый номер) = 20
Ar (относительная атомная масса) = 40
Электронная формула 1S22S22P63S23P64S2
Cильный восстановитель
Степень окисления +2
Слайд 3

Са в природе
3% в земной коре (3 место после Al и
Fe)
Важнейшие соединения Са:
1) СаСО3 – минерал кальцит, образующий мел, мрамор, известняк
2) CaSO4•2H2O – гипс
3) Ca3(PO4)2 - фосфорит
Са – макроэлемент в организме растений, животных и человека(2%)
Слайд 4

Физические свойства
Кальций — металл серебристо-серого цвета, относительно легкий и довольно твердый,
t°плавления = 854 °С, окисляется на воздухе.
Слайд 5

Химические свойства
При обычной температуре Ca легко взаимодействует с кислородом и
влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом.
Слайд 6

Химические свойства
1. С простыми веществами - НЕМЕТАЛЛАМИ:
2Са + О2 → 2СаО
оксид кальция
Ca+O2 → CaO2 пероксид кальция
Са + Н2 → СаН2 гидрид кальция
Ca + 2C → CaC2 карбид кальция
Са + F2 → CaF2 фторид кальция
Са + Br2 → CaBr2 бромид кальция
Са + Cl2 → CaCl2 хлорид кальция
ЗСа + N2 → Са3N2 нитрид магния
ЗСа + 2Р → Са3Р2 фосфид кальция
Са + S → СаS сульфид кальция
Слайд 7

Химические свойства
2. Со сложными веществами:
1) с водой
Ca + 2H2O →
Ca(OH)2 + H2 ↑
2) с кислотами
Ca + H2SO4 → CaSO4 + H2↑
3)восстанавливает менее активные металлы из их оксидов
2Са + ТiO2 = 2СаО + Тi
Слайд 8
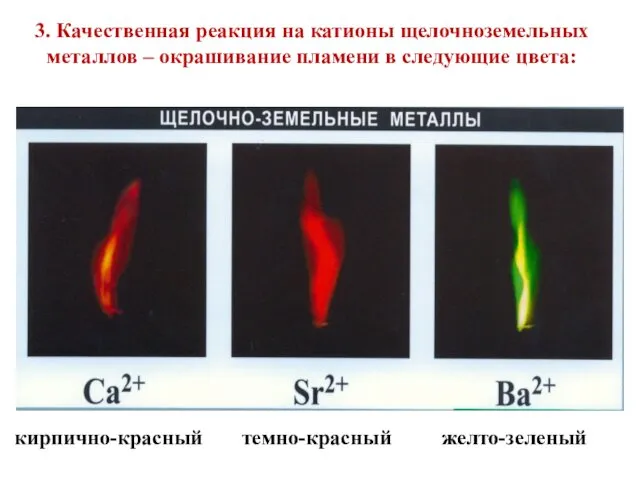
3. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в
следующие цвета:
кирпично-красный
темно-красный
желто-зеленый
Слайд 9

Получение в промышленности
Электролиз расплавов солей кальция
CaCl2 → Ca + Cl2
2.
Алюмотермия с оксидом кальция
3CaО + 2Al → 3Ca + Al2O3
Слайд 10

1. СаО - оксид кальция
СаО – жженая или негашеная известь
Гашение
извести – экзотермическая реакция
СаО + Н2О → Са(ОН)2
Слайд 11

2. Са(ОН)2 - гидроксид кальция
Са(ОН)2 – щелочь
Известковая вода – ненасыщенный раствор
Са(ОН)2
Известковое молоко – пересыщенный раствор Са(ОН)2
Известковый раствор – раствор Са(ОН)2 с песком SiO2










 Внутреннее устройство системного блока пк
Внутреннее устройство системного блока пк Реальное и виртуальное в философии
Реальное и виртуальное в философии Шадринский государственный педагогический университет
Шадринский государственный педагогический университет Игра Города Курской области
Игра Города Курской области Продавец-консультант JD_Ukr
Продавец-консультант JD_Ukr Бионика, как наука
Бионика, как наука 02.21г Лампа накаливания. Электронагревательные приборы
02.21г Лампа накаливания. Электронагревательные приборы презентация Литераторы Кубани 19 век
презентация Литераторы Кубани 19 век Операционно-технологическая карта сборки и сварки металлоконструкции
Операционно-технологическая карта сборки и сварки металлоконструкции Исследовательская работа: игры и фокусы со спичками
Исследовательская работа: игры и фокусы со спичками Уточка мандаринка. 1 класс
Уточка мандаринка. 1 класс Презентация к уроку, Дикие животные.Плетение из бисера
Презентация к уроку, Дикие животные.Плетение из бисера Эллинизм
Эллинизм Миротворчество: военный и гуманитарный аспекты
Миротворчество: военный и гуманитарный аспекты План и карта
План и карта Merry Christmas!
Merry Christmas! Недостаточность кровообращения
Недостаточность кровообращения МАСТЕР-КЛАСС БОЖЬЯ КОРОВКА ИЗ ПЛАСТИКОВЫХ ЛОЖЕК
МАСТЕР-КЛАСС БОЖЬЯ КОРОВКА ИЗ ПЛАСТИКОВЫХ ЛОЖЕК Подарочная коробочка
Подарочная коробочка Беспилотный летательный аппарат (БПЛА). Виды и устройство. Работа и применение
Беспилотный летательный аппарат (БПЛА). Виды и устройство. Работа и применение Автоматизация телекоммуникационных систем гостиницы
Автоматизация телекоммуникационных систем гостиницы Реография. Реограмма. Реоэнцефалография (РЭГ)
Реография. Реограмма. Реоэнцефалография (РЭГ) Studying Competitive Antagonism on Isolated Rabbit Jejunum
Studying Competitive Antagonism on Isolated Rabbit Jejunum Основы управления рисками
Основы управления рисками Презентация к родительскому собранию Как приобщить ребенка к чтению
Презентация к родительскому собранию Как приобщить ребенка к чтению The United Kingdom of Great Britain and Northern Ireland is an island nation in the north-west of continental Europe
The United Kingdom of Great Britain and Northern Ireland is an island nation in the north-west of continental Europe Христианство в современном мире
Христианство в современном мире Знаки: больше, меньше и равно
Знаки: больше, меньше и равно