Содержание
- 2. Вспомним о водороде. Химический знак водорода. Его положение в ПСХЭ. Распространение водорода. Способы получения и определения.
- 3. Запишем д/з: §14 прочитать, составить кроссворд из 10 любых химических терминов.
- 4. Нахождение в природе Кислород самый распространенный на Земле элемент. 1. В атмосфере около 21% по V;
- 5. Открытие кислорода Официально открытие принадлежит Джозефу Присли. (1 августа 1774 году путём разложения оксида ртути в
- 6. АЛЛОТРОПИЯ КИСЛОРОДА: элементу-О соответствуют 2 простых вещества Газ кислород -О2 Газ озон - О3 образуется из
- 7. Физические свойства 1.Кислород-газ без цвета, запаха и вкуса, мало растворим в воде, тяжелее воздуха, Ткип.=-183 0С;
- 8. Получение кислорода KMnO4 →K2MnO4+MnO2 +O2 KNO3 →KNO2 +O2 H2O2 →H2O + O2 Уравнить
- 9. Химические свойства кислорода
- 10. Горение железа. Fe + О2 → Fe2O3 уравнить
- 11. Горение фосфора. Р + О2 → Р2O5 уравнить
- 12. Горение серы. S + О2 → SO2 уравнить
- 13. ПРАВИЛА ДОПИСЫВАНИЯ УРАВНЕНИЙ РЕАКЦИЙ СОЕДИНЕНИЯ. 1.Записать элементы вместе. 2.Поставить с.о. элементов. Снести их крест-накрест, если, надо-
- 14. Дописать и уравнить: 1. Ca + O2 → 2. H2 + O2 → 3. Si +
- 15. Угадать пропущенное вещество … + O2 → As2O3 Li + O2 →… Mg + … →
- 16. Применение 1.Медицина Абсолютно необходимый элемент системы жизнеобеспечения любой больницы. Применяется при анестезии, для работы ИВЛ, физиотерапии.
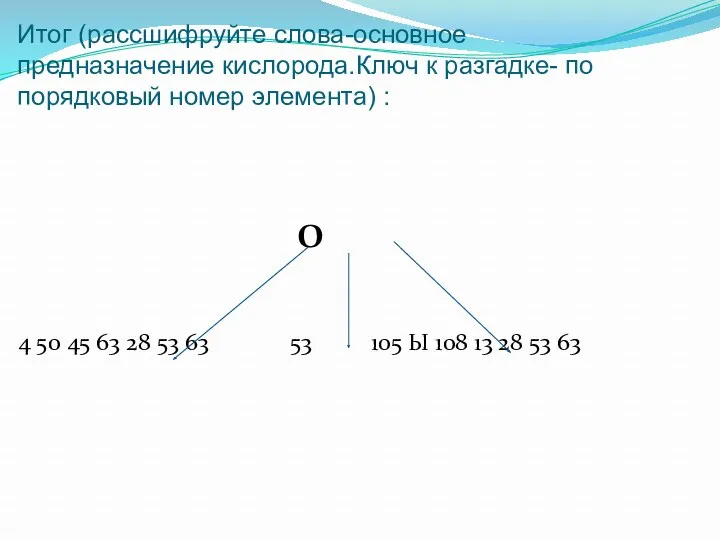
- 17. Итог (рассшифруйте слова-основное предназначение кислорода.Ключ к разгадке- по порядковый номер элемента) : O 4 50 45
- 18. ДЫХАНИЕ И ГОРЕНИЕ
- 20. Скачать презентацию
















 20231013_arifmeticheskie_deystviya_s_mnogoznachnymi_naturalnymi_chislami
20231013_arifmeticheskie_deystviya_s_mnogoznachnymi_naturalnymi_chislami портфолио ученика начальных классов
портфолио ученика начальных классов Самообразование учителя физики как способ повышения профессиональной компетентности в современных условиях
Самообразование учителя физики как способ повышения профессиональной компетентности в современных условиях Презентация к конспекту занятия в группе старшего возраста для детей с ТНР по теме: Дикие животные весной
Презентация к конспекту занятия в группе старшего возраста для детей с ТНР по теме: Дикие животные весной Портфолио, младшая возрастная группа
Портфолио, младшая возрастная группа Введение в робототехнику
Введение в робототехнику День Защитника Отечества
День Защитника Отечества Родительское собрание в 1 классе на тему:Как помочь ребенку быть внимательным?
Родительское собрание в 1 классе на тему:Как помочь ребенку быть внимательным? История трансформации пассажирского самолёта
История трансформации пассажирского самолёта Презентация - конспект классного часа Масленица
Презентация - конспект классного часа Масленица Северная Америка. История исследования
Северная Америка. История исследования Микропроцессоры. Основные сведения о микропроцессорах
Микропроцессоры. Основные сведения о микропроцессорах Внутренняя энергия. Термодинамика
Внутренняя энергия. Термодинамика Золотое кольцо Кубани. Православные монастыри
Золотое кольцо Кубани. Православные монастыри Расстройства местного кровообращения
Расстройства местного кровообращения Выступление на ШМО Формирование у детей интереса к работе со словарными словами
Выступление на ШМО Формирование у детей интереса к работе со словарными словами СВЧ антенны
СВЧ антенны Символика ЮГРЫ
Символика ЮГРЫ Антон Павлович Чехов 1860-1904
Антон Павлович Чехов 1860-1904 Развитие фонематического слуха у детей старшего дошкольного возраста
Развитие фонематического слуха у детей старшего дошкольного возраста Киберспорт в России и СНГ: история, текущее состояние и перспективы
Киберспорт в России и СНГ: история, текущее состояние и перспективы ПРОФЕССИОНАЛЬНОЕ САМОСОВЕРШЕНСТВОВАНИЕ ПЕДАГОГА
ПРОФЕССИОНАЛЬНОЕ САМОСОВЕРШЕНСТВОВАНИЕ ПЕДАГОГА Городской конкурс Учитель года 2014. 4 день. Открытый урок.
Городской конкурс Учитель года 2014. 4 день. Открытый урок. Азбука безопасности. презентация по правилам дорожного движения с интерактивной викториной для 1-го класса
Азбука безопасности. презентация по правилам дорожного движения с интерактивной викториной для 1-го класса Обработка горловины подкройной обтачкой
Обработка горловины подкройной обтачкой Положение человека в системе животного мира. Эволюция приматов. Стадии эволюции человека
Положение человека в системе животного мира. Эволюция приматов. Стадии эволюции человека Функции менеджмента в досуговой деятельности
Функции менеджмента в досуговой деятельности Конспект урока по теме: Простые задачи на нахождение процентов
Конспект урока по теме: Простые задачи на нахождение процентов