Слайд 2
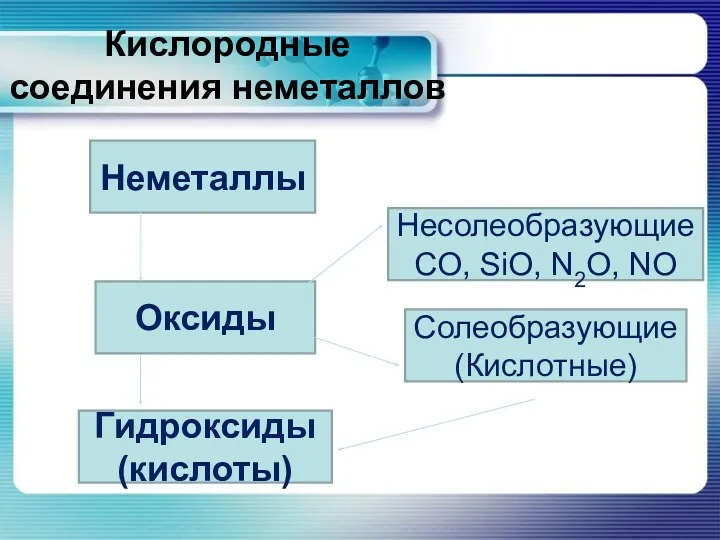
Кислородные соединения неметаллов
Неметаллы
Оксиды
Гидроксиды (кислоты)
Несолеобразующие CO, SiO, N2O, NO
Солеобразующие (Кислотные)
Слайд 3

Оксиды
Кристаллическая решетка:
Преимущественно молекулярная, SiO2 - атомная
Физические свойства:
газы(CO2, SO2, CO, NO2),
жидкости(H2O, N2O3, SO3 ),
твердые вещества(SiO2, P2O5, N2O5)
Слайд 4

Оксиды
Для кислотных оксидов часто используется название «ангидрид» – продукт отношения воды
и соответствующей кислоты.
Слайд 5

Оксиды
Химические свойства:
Несолеобразующие CO, SiO, N2O, NO
Солеобразующие (Кислотные)
Изменение кислотно-основных свойств оксидов и
соответствующих им кислот в периоде и группе (см. учебник стр.233)
Слайд 6

Оксиды
Изменение кислотно-основных свойств оксидов и соответствующих им кислот с изменением степени
окисления элемента (см. учебник стр.233)
Слайд 7

Оксиды
При растворении в воде кислотных оксидов образуются гидроксиды – кислоты, в
которых сохраняется с.о. неметалла (искл. SiO2 нерастворим в воде)
Слайд 8

Оксиды
У оксидов NO2 и ClO2 нет соответств-х кислотных гидроксидов.
При их растворении
в воде происходят реакции диспропорционирования, продукты реакции зависят от темп-ры.
2NO2 + H2O = HNO3 + HNO2 (хол.)
3NO2 + H2O = 2HNO3 + NO (гор.)
2ClO2 + H2O = HClO3 + HClO2 (хол.)
6ClO2 + 3H2O = 5HClO3 + HCl (гор.)
Слайд 9

Оксиды
При растворении в воде P2O5 в зависимости от числа присоединенных молекул
воды могут образовываться три кислоты:
метафосфорная HPO3
пирофосфорная H4P2O7
ортофосфорная H3PO4
Слайд 10

Оксиды
В реакциях протекающих без изменения с.о. оксиды неметаллов проявляют все общие
свойства кислотных оксидов.
Перечислите их пожалуйста.
Слайд 11

Оксиды
Оксиды NO2 и ClO2 при взаимодействии со щелочами образуют две соли
ClO2
+ NaOH (хол.) =
ClO2 + NaOH (гор.) =
NO2 + NaOH (хол.) =
Слайд 12

Оксиды
ОВР
Под действием кислорода при нагревании или в присутствии катализатора низшие оксиды
переходят в высшие
NO + O2 =
SO2 + O2 =
Слайд 13

Оксиды
Оксиды с атомами неметаллов в максимальной с.о. являются окислителями
CO2 +
C =
SiO2 + Mg =
P2O5 + C =
Допишите пожалуйста уравнения реакций
(при затруднении см. учебник стр. 233)
Слайд 14

Оксиды
Оксиды с атомами неметаллов в промежуточной с.о. обладают окислительно-восстановительной двойственностью:
SO2 +
H2S =
SO2 + NO2 =
Слайд 15

Оксиды
Кислотные оксиды редко взаимодействуют друг с другом (P2O5 может отнимать воду
у других кислот)
P2O5 + 2HClO4 = Cl2O7 + 2HPO3
P2O5 + HNO3 = N2O5 + 2HPO3
Слайд 16

Пероксид водорода
Степень окисления кислорода -1
Обладает окислительно-восстановительной двойственностью с преобладанием окислительных свойств.
(запишите
уравнения реакций из учебника стр. 235)
Слайд 17

H2O2
Окислительные свойства
H2O2 + H2SO4 + KI = I2↓ + H2O +
K2SO4
H2O2 + KI = I2↓ + KOH
H2O2 + H2SO4 + FeSO4 = Fe2(SO4)3 + + H2O
H2O2 + PbS = PbSO4 + H2O
H2O2 + Mn(OH)2 = MnO2 + H2O
Слайд 18
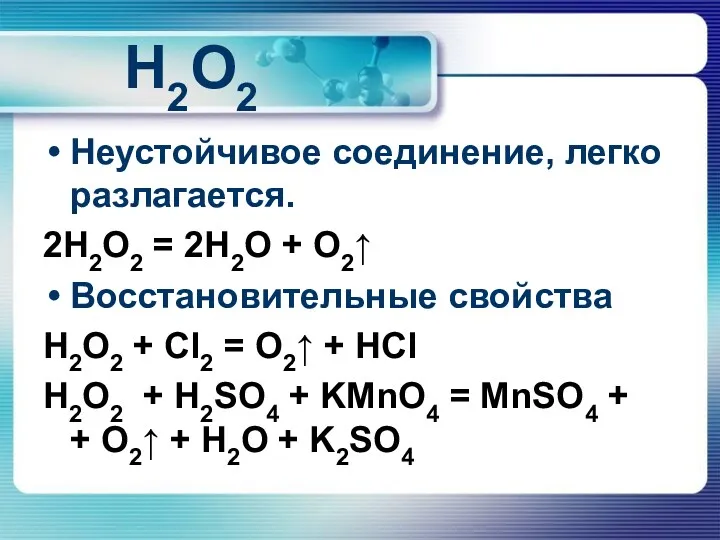
H2O2
Неустойчивое соединение, легко разлагается.
2H2O2 = 2H2O + O2↑
Восстановительные свойства
H2O2 + Cl2
= O2↑ + HCl
H2O2 + H2SO4 + KMnO4 = MnSO4 + + O2↑ + H2O + K2SO4

















 Принципы здорового питания
Принципы здорового питания Представление учителя истории и обществознания первой квалификационной категории ГБОУ сош школы-интерната №2 Адмиралтейского района Санкт-Петербурга Полонской Галины Викторовны
Представление учителя истории и обществознания первой квалификационной категории ГБОУ сош школы-интерната №2 Адмиралтейского района Санкт-Петербурга Полонской Галины Викторовны Фортуна (математическая игра)
Фортуна (математическая игра) Экономическое обоснование организации зоны ТО и ТР СТО ООО Ника
Экономическое обоснование организации зоны ТО и ТР СТО ООО Ника Выступление на ШМО на тему: Характеристика изменений в деятельности учащихся и их родителей в условиях введения ФГОС
Выступление на ШМО на тему: Характеристика изменений в деятельности учащихся и их родителей в условиях введения ФГОС Региональная общественная организация развития молодёжных инициатив Лига молодёжной политики Республики Башкортостан
Региональная общественная организация развития молодёжных инициатив Лига молодёжной политики Республики Башкортостан Внешняя политика России во второй половине XIX в
Внешняя политика России во второй половине XIX в Лазерный принтер
Лазерный принтер Что надо знать, чтобы не болеть (презентация).
Что надо знать, чтобы не болеть (презентация). Жүйелі васкулиттер
Жүйелі васкулиттер Snow Globe
Snow Globe Арматура систем водоснабжения зданий. Материал труб
Арматура систем водоснабжения зданий. Материал труб Табак и табачные изделия изделия
Табак и табачные изделия изделия История государства и права древней Индии
История государства и права древней Индии Маркетинговая информация и маркетинговые исследования
Маркетинговая информация и маркетинговые исследования Тропинки здоровья
Тропинки здоровья Обществознание. 8 класс. Общество и общественные отношения
Обществознание. 8 класс. Общество и общественные отношения Аварии на химически опасных объектах и их возможные последствия
Аварии на химически опасных объектах и их возможные последствия Священные сооружения мировых религиозных культур. Проверочная работа. 5 класс
Священные сооружения мировых религиозных культур. Проверочная работа. 5 класс Связь поляризованности диэлектрика в электростатическом поле с плотностью связанных зарядов
Связь поляризованности диэлектрика в электростатическом поле с плотностью связанных зарядов Металлические конструкции и испытания сооружений
Металлические конструкции и испытания сооружений Урок географии в 7 классе по теме Страны Северной Европы
Урок географии в 7 классе по теме Страны Северной Европы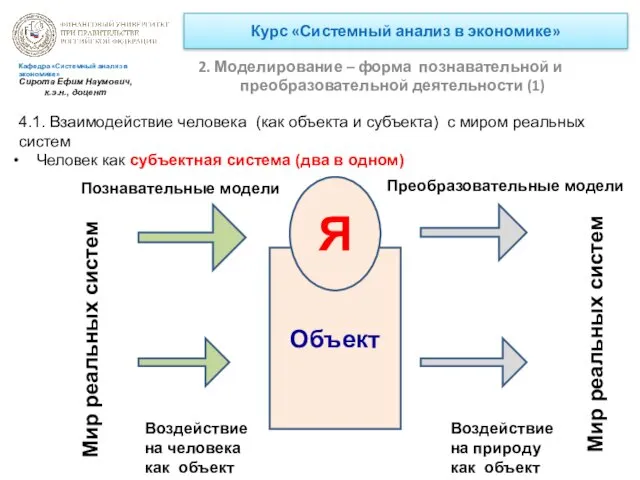 Системный анализ в экономике. Моделирование – форма познавательной и преобразовательной деятельности
Системный анализ в экономике. Моделирование – форма познавательной и преобразовательной деятельности Уровень комфорта
Уровень комфорта презентация к мастер - классу
презентация к мастер - классу Инженерные сети: газопровод
Инженерные сети: газопровод Презентація_8
Презентація_8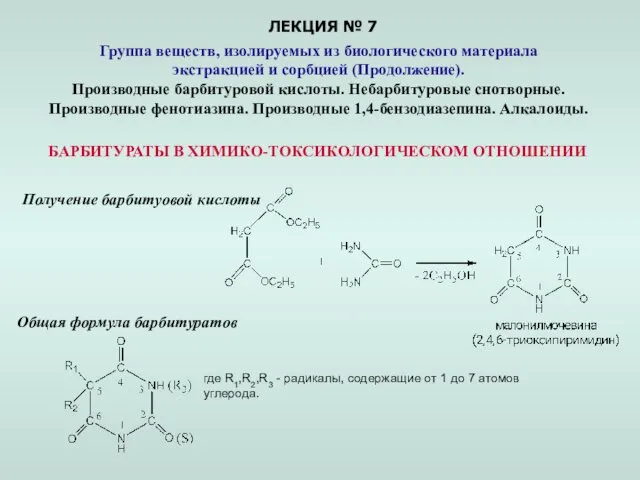 Группа веществ, изолируемых из биологического материала экстракцией и сорбцией. (Лекция 7)
Группа веществ, изолируемых из биологического материала экстракцией и сорбцией. (Лекция 7)