Содержание
- 2. Задание 1. Соотнесите: [H⁺] [ОHˉ] pH Среда I) 10ˉ¹² А)10ˉ¹¹ 1) 3 а) кислотная II) 10ˉ³
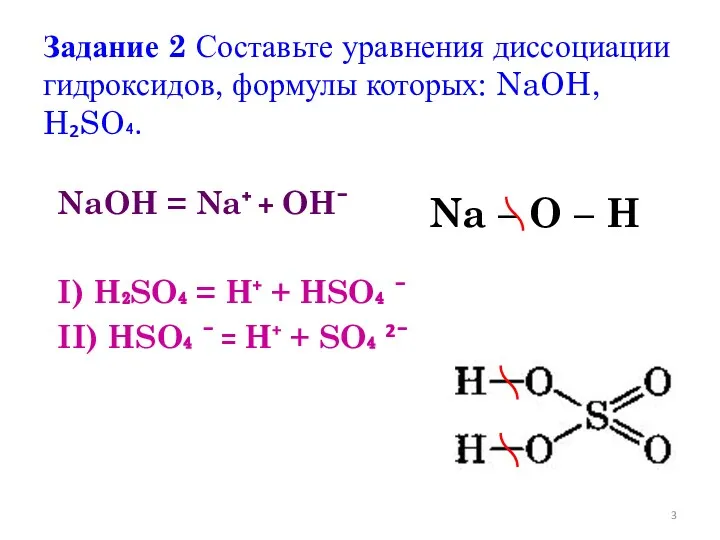
- 3. Задание 2 Составьте уравнения диссоциации гидроксидов, формулы которых: NaOH, H₂SO₄. NaOH = Na⁺ + OHˉ I)
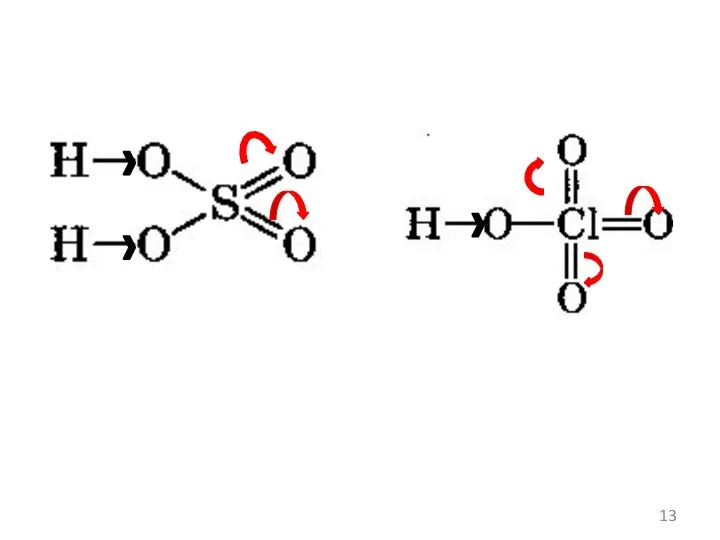
- 4. По каким направлениям протекает диссоциация гидроксидов? Э – О – Н по основному типу (разрыв связи
- 5. Что определяет характер электролитической диссоциации соединений?
- 6. Цель: определить зависимость кислотно-основных свойств гидроксидов от положения элементов, образующих данные вещества, в Периодической системе химических
- 7. Тема урока Кислотно-основные свойства гидроксидов
- 8. Гидроксиды элементов третьего периода +1 +2 +3 +4 +5 +6 +7 NaOH Mg(OH)₂ Al(OH)₃ H₂SiO₃ H₃PO₄
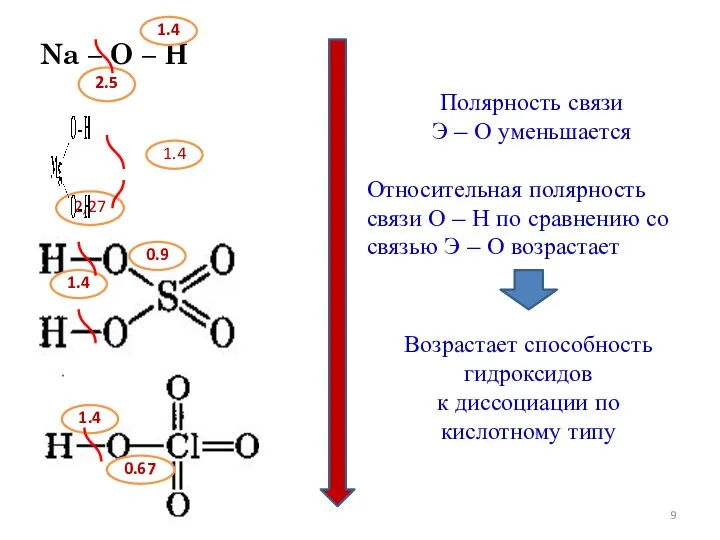
- 9. Na – O – H 2.5 1.4 1.4 1.4 1.4 0.9 0.67 2,27 Полярность связи Э
- 10. Гидроксиды элементов третьего периода +1 +2 +3 +4 +5 +6 +7 NaOH Mg(OH)₂ Al(OH)₃ H₂SiO₃ H₃PO₄
- 11. Задание 3 Приведенные формулы гидроксидов расположите в порядке увеличения кислотных свойств веществ: H₂CO₃, H₃BO₃, HNO₃, LiOH,
- 12. Физминутка
- 14. Задание 4 Расположите формулы в порядке увеличения силы кислот: HClO₃, HClO₂, HClO₄, HClO. Ответ: HClO, HClO₂,
- 15. Mn(OH)₂ Mn(OH)₃ Mn(OH)₄ H₂MnO₄ HMnO₄ Вывод: с увеличением степени окисления элемента в ряду его гидроксидов основные
- 16. Вывод: возрастает способность гидроксидов к диссоциации по основному типу. +2 +2 +2 +2 2,03 2,27 2,46
- 17. 1. Кислотно-основные свойства гидроксидов зависят от взаимного влияния атомов в соединениях. 2. Характер диссоциации определяется полярностью
- 19. Скачать презентацию
![Задание 1. Соотнесите: [H⁺] [ОHˉ] pH Среда I) 10ˉ¹² А)10ˉ¹¹](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/552787/slide-1.jpg)












 Объем пирамиды
Объем пирамиды 20230228_nalogi
20230228_nalogi День Конституции 12 декабря 1993 года
День Конституции 12 декабря 1993 года Внеклассное мероприятие Турнир географов
Внеклассное мероприятие Турнир географов Рациональное экономическое поведение собственника, работника, потребителя. Урок 8
Рациональное экономическое поведение собственника, работника, потребителя. Урок 8 Философия Ренессанса. Рубеж XIV-XV – начало XVII века
Философия Ренессанса. Рубеж XIV-XV – начало XVII века Экономия электроэнергии для стиральной машины
Экономия электроэнергии для стиральной машины Microsoft Windows RPC Security Vulnerabilities
Microsoft Windows RPC Security Vulnerabilities Сlothing industry
Сlothing industry Природа человека. Изучение нового материала
Природа человека. Изучение нового материала Правила вербальных коммуникаций
Правила вербальных коммуникаций Правила надлежащей производственной практики применительно к биотехнологии. Международные стандарты GMP
Правила надлежащей производственной практики применительно к биотехнологии. Международные стандарты GMP Поиск информации в Интернете
Поиск информации в Интернете Компьютерлiк желiлер негiздерi
Компьютерлiк желiлер негiздерi Информационное моделирование. Построение модели биоритмов человека в среде табличного процессора
Информационное моделирование. Построение модели биоритмов человека в среде табличного процессора Музыка в цирке
Музыка в цирке Интеллектуальный марафон. Занятие 1 (3 класс)
Интеллектуальный марафон. Занятие 1 (3 класс) Строение и функциональное значение различных отделов ЦНС
Строение и функциональное значение различных отделов ЦНС Твердотельная электроника
Твердотельная электроника Лечебные и диагностические сыворотки и методы их получения
Лечебные и диагностические сыворотки и методы их получения Дисперсные системы
Дисперсные системы Родительское собрание во 2 классе Критерии оценок во 2 классе. Первая оценка и как к ней относиться
Родительское собрание во 2 классе Критерии оценок во 2 классе. Первая оценка и как к ней относиться Конспект урока и презентация к уроку географии Западная и Центральная Африка. Нигерия.
Конспект урока и презентация к уроку географии Западная и Центральная Африка. Нигерия. Презентация к устному журналу Это страшное слово - БЛОКАДА
Презентация к устному журналу Это страшное слово - БЛОКАДА Закономерности распростанения типов почв и почвенные ресурсы России
Закономерности распростанения типов почв и почвенные ресурсы России Спортивное ориентирование. Пеший туризм
Спортивное ориентирование. Пеший туризм Основания. Состав оснований
Основания. Состав оснований Конструктивные элементы электромеханических измерительных приборов
Конструктивные элементы электромеханических измерительных приборов