Содержание
- 2. монтмориллонит: Pb2+ > Cu2+ > Cd2+ > Zn2+ иллит: Pb2+ > Cu2+ > Zn2+ > Cd2+
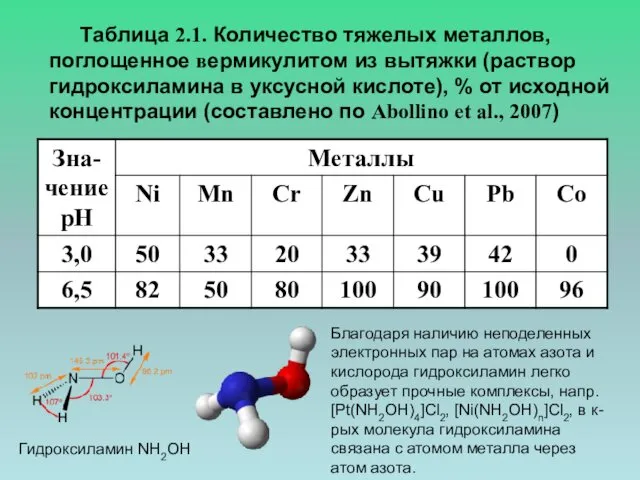
- 3. Таблица 2.1. Количество тяжелых металлов, поглощенное вермикулитом из вытяжки (раствор гидроксиламина в уксусной кислоте), % от
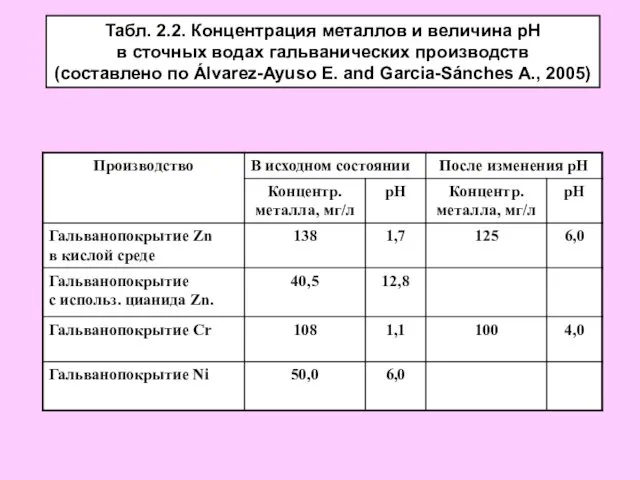
- 4. Табл. 2.2. Концентрация металлов и величина рН в сточных водах гальванических производств (составлено по Álvarez-Ayuso E.
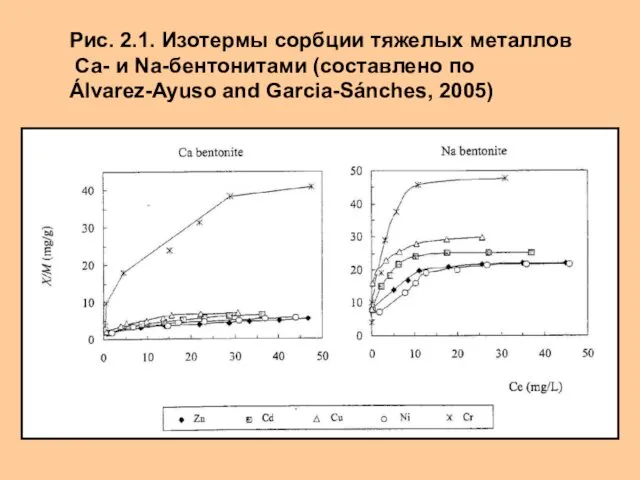
- 5. Рис. 2.1. Изотермы сорбции тяжелых металлов Са- и Na-бентонитами (составлено по Álvarez-Ayuso and Garcia-Sánches, 2005)
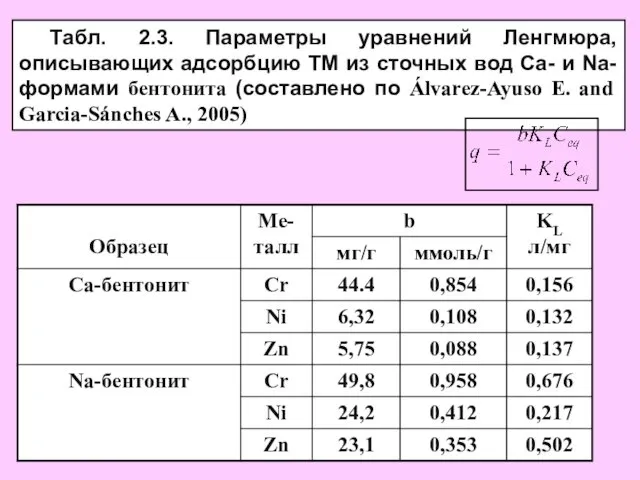
- 6. Табл. 2.3. Параметры уравнений Ленгмюра, описывающих адсорбцию ТМ из сточных вод Ca- и Na-формами бентонита (составлено
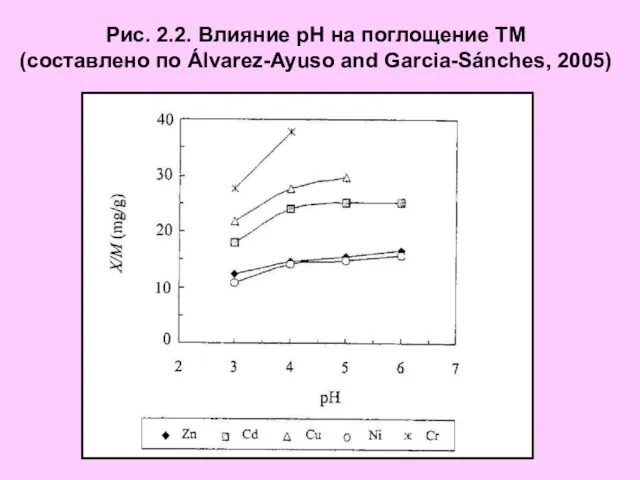
- 7. Рис. 2.2. Влияние рН на поглощение ТМ (составлено по Álvarez-Ayuso and Garcia-Sánches, 2005)
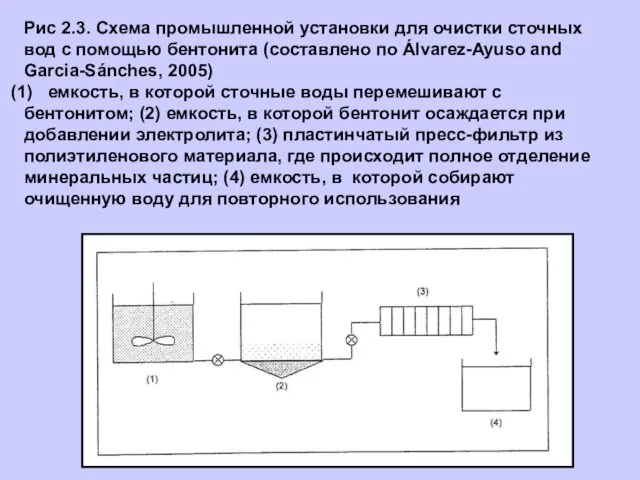
- 8. Рис 2.3. Схема промышленной установки для очистки сточных вод с помощью бентонита (составлено по Álvarez-Ayuso and
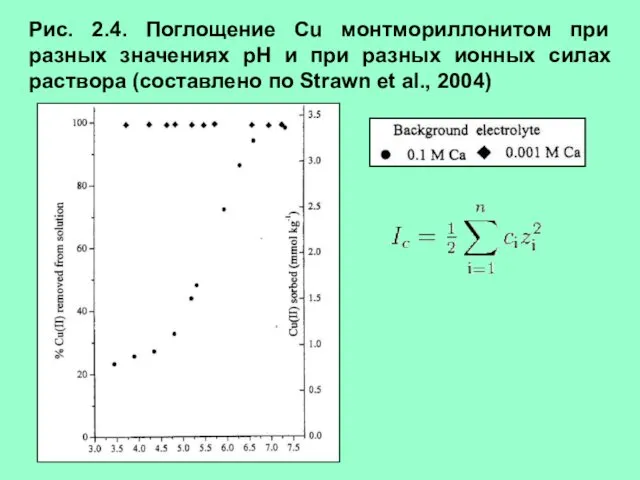
- 9. Рис. 2.4. Поглощение Cu монтмориллонитом при разных значениях рН и при разных ионных силах раствора (составлено
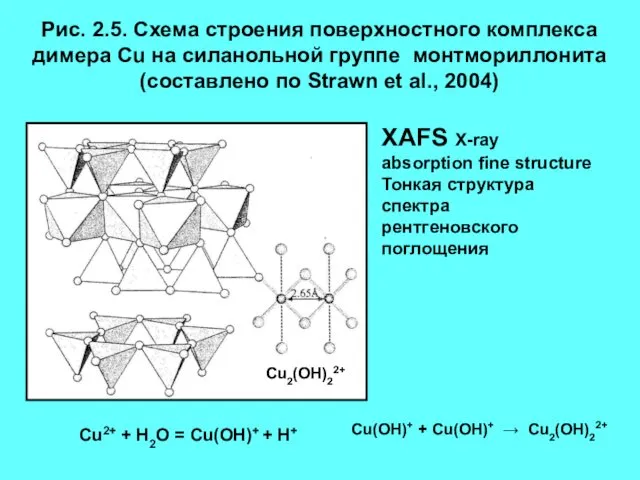
- 10. Рис. 2.5. Схема строения поверхностного комплекса димера Сu на силанольной группе монтмориллонита (составлено по Strawn et
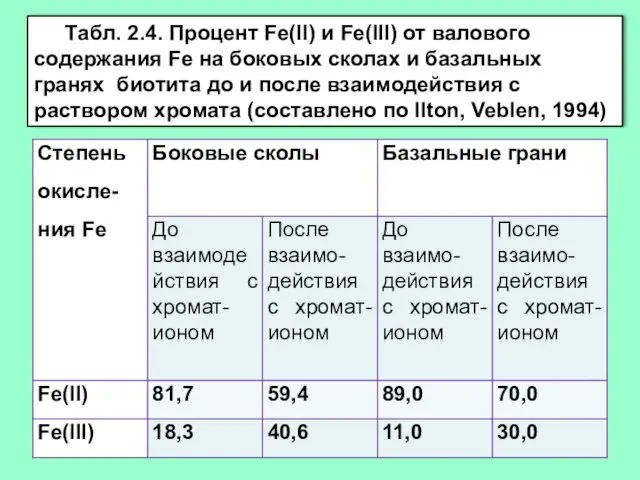
- 11. Табл. 2.4. Процент Fe(II) и Fe(III) от валового содержания Fe на боковых сколах и базальных гранях
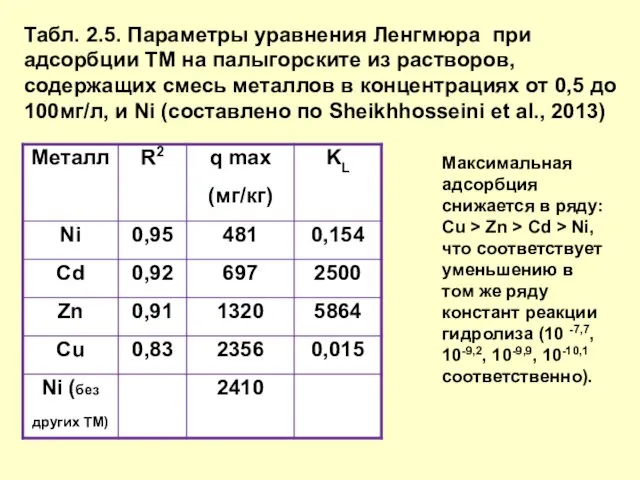
- 12. Табл. 2.5. Параметры уравнения Ленгмюра при адсорбции ТМ на палыгорските из растворов, содержащих смесь металлов в
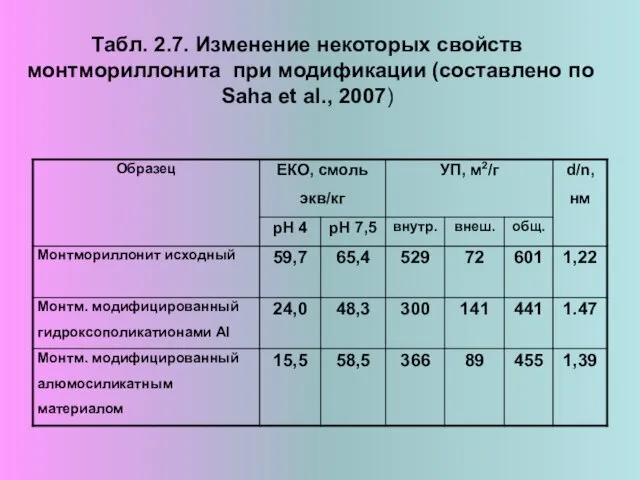
- 13. Табл. 2.7. Изменение некоторых свойств монтмориллонита при модификации (составлено по Saha et al., 2007)
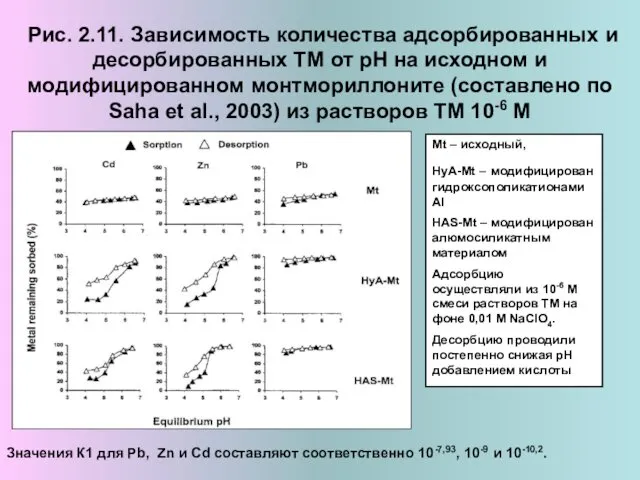
- 14. Рис. 2.11. Зависимость количества адсорбированных и десорбированных ТМ от рН на исходном и модифицированном монтмориллоните (составлено
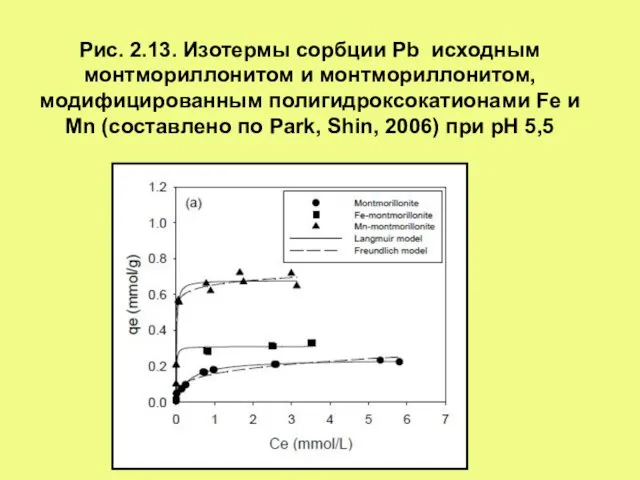
- 15. Рис. 2.13. Изотермы сорбции Pb исходным монтмориллонитом и монтмориллонитом, модифицированным полигидроксокатионами Fe и Mn (составлено по
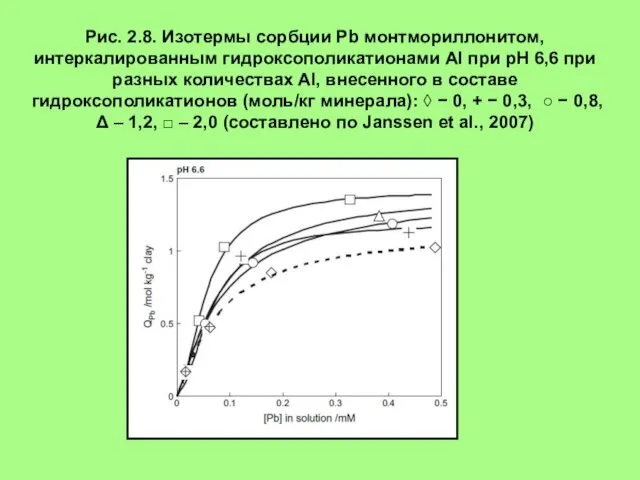
- 16. Рис. 2.8. Изотермы сорбции Pb монтмориллонитом, интеркалированным гидроксополикатионами Al при рН 6,6 при разных количествах Al,
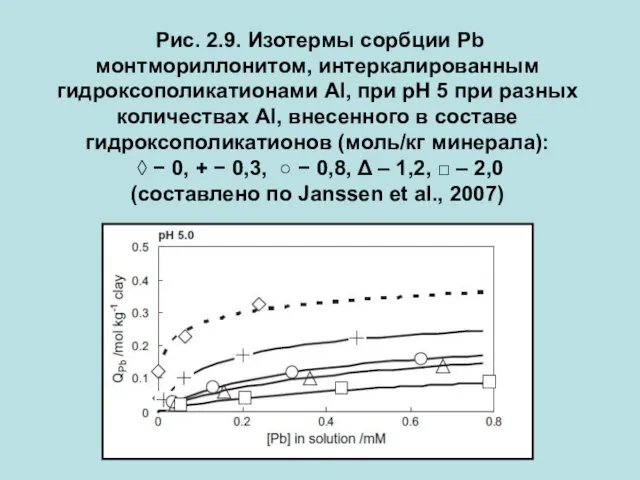
- 17. Рис. 2.9. Изотермы сорбции Pb монтмориллонитом, интеркалированным гидроксополикатионами Al, при рН 5 при разных количествах Al,
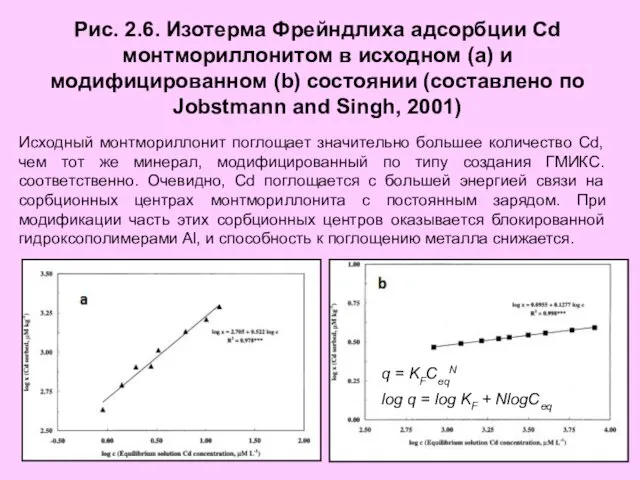
- 18. Рис. 2.6. Изотерма Фрейндлиха адсорбции Cd монтмориллонитом в исходном (a) и модифицированном (b) состоянии (составлено по
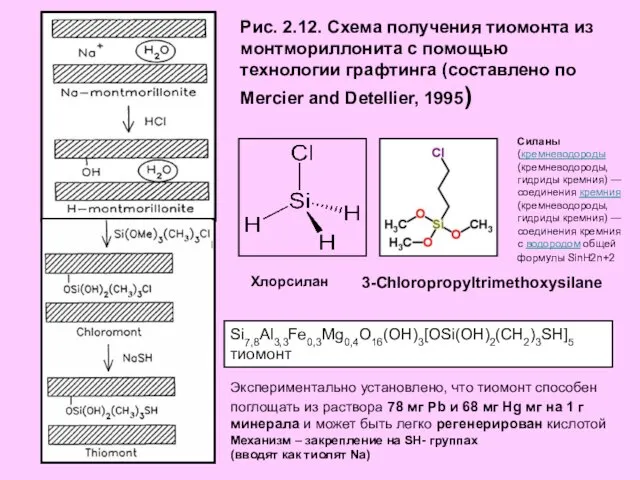
- 19. Рис. 2.12. Схема получения тиомонта из монтмориллонита с помощью технологии графтинга (составлено по Mercier and Detellier,
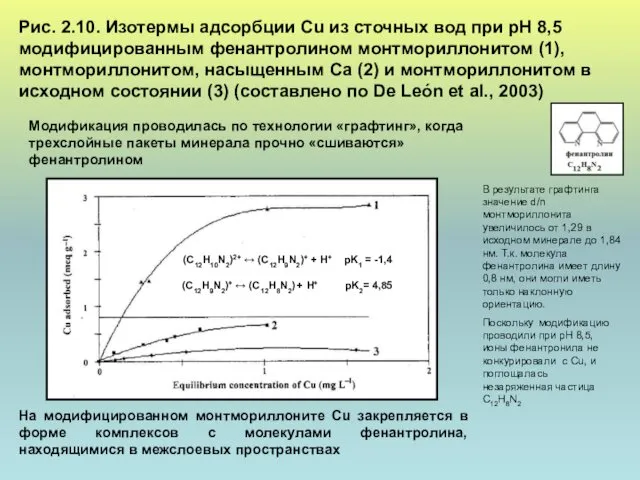
- 20. Рис. 2.10. Изотермы адсорбции Cu из сточных вод при рН 8,5 модифицированным фенантролином монтмориллонитом (1), монтмориллонитом,
- 21. Табл. 2.6. Параметры уравнения Ленгмюра для процесса адсорбции Cu монтмориллонитом (составлено по de León et al.,
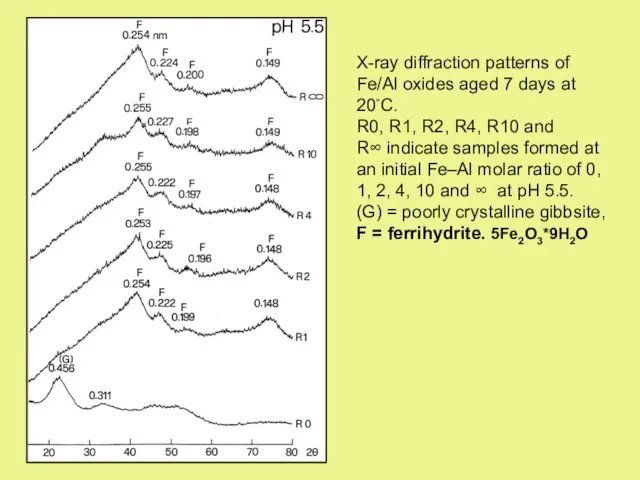
- 22. X-ray diffraction patterns of Fe/Al oxides aged 7 days at 20◦C. R0, R1, R2, R4, R10
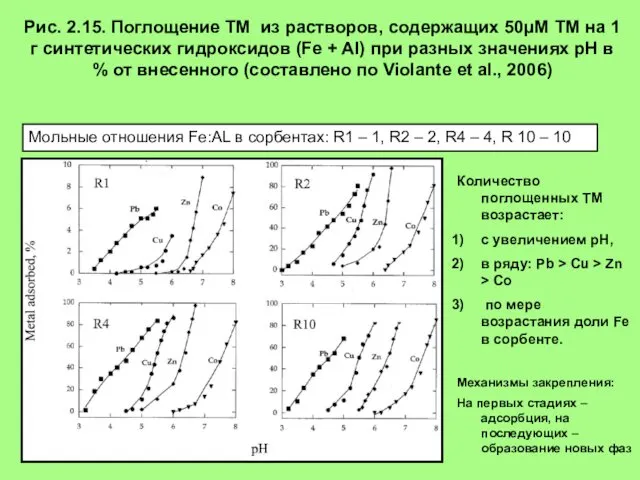
- 23. Рис. 2.15. Поглощение ТМ из растворов, содержащих 50μM ТМ на 1 г синтетических гидроксидов (Fe +
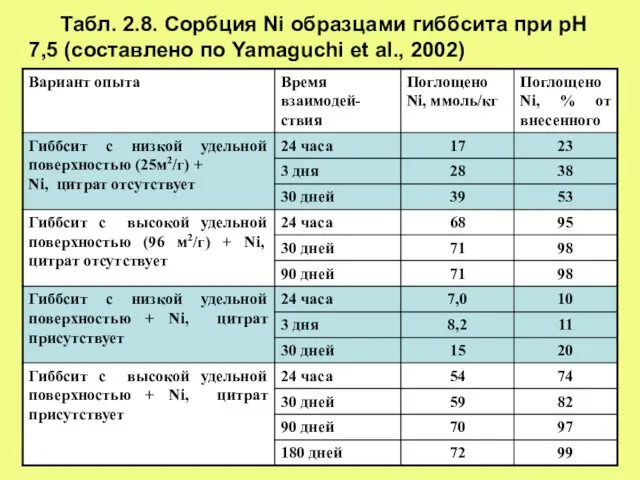
- 24. Табл. 2.8. Сорбция Ni образцами гиббсита при рН 7,5 (составлено по Yamaguchi et al., 2002)
- 25. Рис. 2.16. Внутрисферный комплекс Ni на поверхности гиббсита (составлено по Yamaguchi et al., 2002) По данным
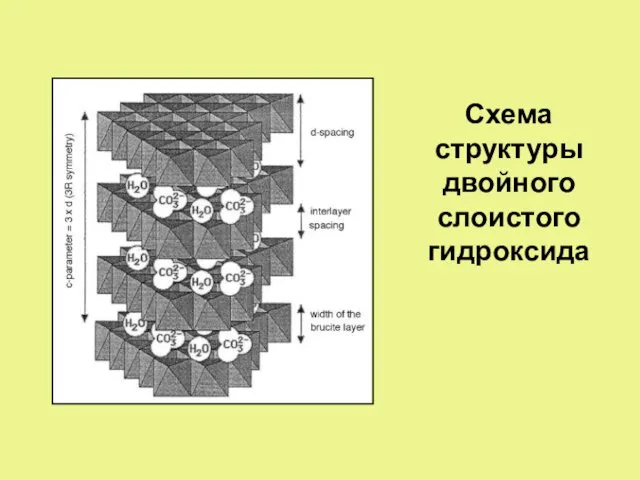
- 26. Схема структуры двойного слоистого гидроксида
- 28. Скачать презентацию



 Игровая зависимость (лудомания)
Игровая зависимость (лудомания) Продвижение в интернете. Посадочная страница (landing page)
Продвижение в интернете. Посадочная страница (landing page) Смотр знаний в 6 классе по обществознанию
Смотр знаний в 6 классе по обществознанию 20191101_net_v_rossii_semi_takoy_gde_b_ne_pamyaten_byl_svoy_geroy
20191101_net_v_rossii_semi_takoy_gde_b_ne_pamyaten_byl_svoy_geroy Классный час Они выстояли
Классный час Они выстояли Рассказ Легкого дыхания, И.А. Бунина. Мини-размышление по сцене убийства Оленьки казачьим офицером
Рассказ Легкого дыхания, И.А. Бунина. Мини-размышление по сцене убийства Оленьки казачьим офицером Личность. Развитие личности: самосознание, самооценка
Личность. Развитие личности: самосознание, самооценка Михаил Александрович Зенкевич
Михаил Александрович Зенкевич Частичка меня
Частичка меня Слова, отвечающие на вопросы КТО? и ЧТО?
Слова, отвечающие на вопросы КТО? и ЧТО? 10 класс. Китай
10 класс. Китай Меры центральной тенденции
Меры центральной тенденции Аудиторские доказательства
Аудиторские доказательства Игра Пчёлка собирает мёд на дифференциацию букв З - С
Игра Пчёлка собирает мёд на дифференциацию букв З - С В царстве грибов
В царстве грибов Тренинги для развития навыка быстрого чтения (часть 1)
Тренинги для развития навыка быстрого чтения (часть 1) Трассовый радиолокационный комплекс Сопка-2. Режимы обзора и зоны обнаружения ПОРЛ ТРЛК Сопка-2
Трассовый радиолокационный комплекс Сопка-2. Режимы обзора и зоны обнаружения ПОРЛ ТРЛК Сопка-2 Школьное объединение детей и подростков РИТМ (романтики, искатели, творители, мечтатели)
Школьное объединение детей и подростков РИТМ (романтики, искатели, творители, мечтатели) Искру туши до пожара, беду отводи до удара.
Искру туши до пожара, беду отводи до удара. Сумма n первых членов арифметической прогрессии
Сумма n первых членов арифметической прогрессии Христианская семья
Христианская семья Презентация Флаг России
Презентация Флаг России 1 класс _Красота музыки_
1 класс _Красота музыки_ Тьюторское сопровождение учащихся на 1 ступени обучения
Тьюторское сопровождение учащихся на 1 ступени обучения Национальный рейтинг состояния инвестиционного климата в РФ
Национальный рейтинг состояния инвестиционного климата в РФ Тарковский
Тарковский Церковь и государство 16 век
Церковь и государство 16 век Особенности программ дополнительного образования
Особенности программ дополнительного образования