Содержание
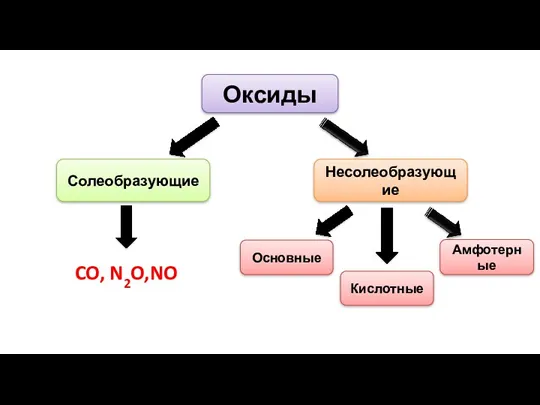
- 2. Оксиды Солеобразующие Несолеобразующие CO, N2O,NO Основные Амфотерные Кислотные
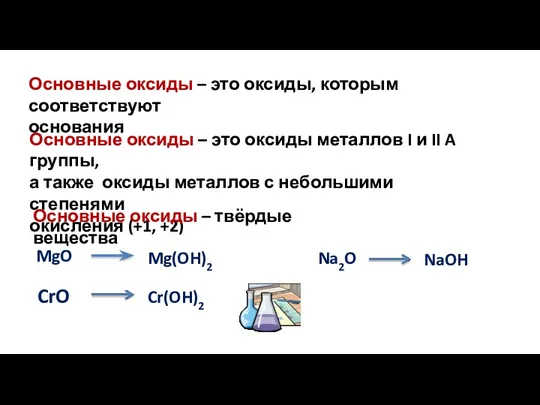
- 3. Основные оксиды – это оксиды, которым соответствуют основания Основные оксиды – это оксиды металлов I и
- 4. CuO + H2SO4 = CuSO4 + H2O Реакция основных оксидов с кислотами Основный оксид + кислота
- 5. CO2 + Ca(OH)2 = CaCO3↓ + H2O CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
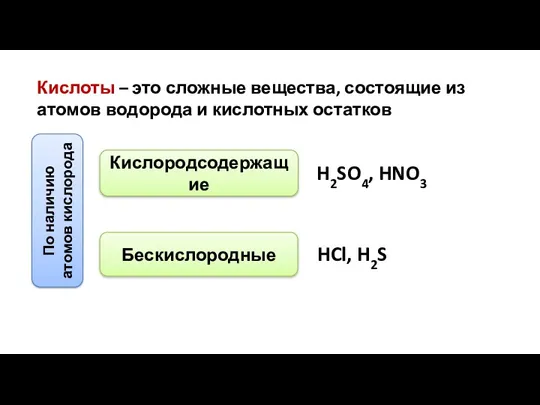
- 6. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков По наличию атомов кислорода
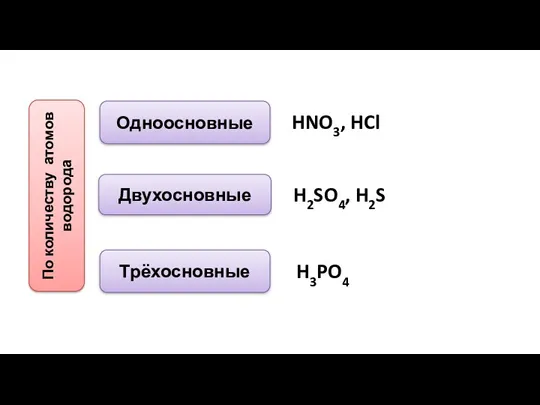
- 7. По количеству атомов водорода Одноосновные Двухосновные Трёхосновные HNO3, HCl H2SO4, H2S H3PO4
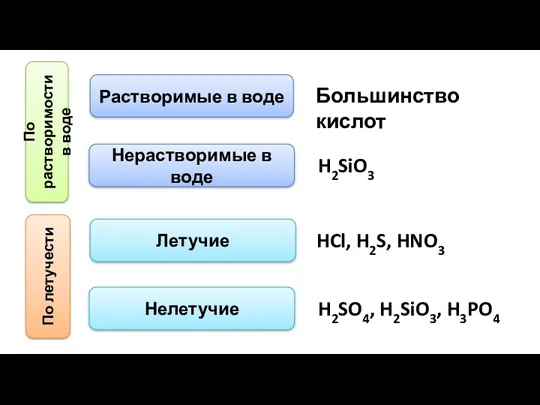
- 8. По растворимости в воде Растворимые в воде Нерастворимые в воде Большинство кислот H2SiO3 По летучести Летучие
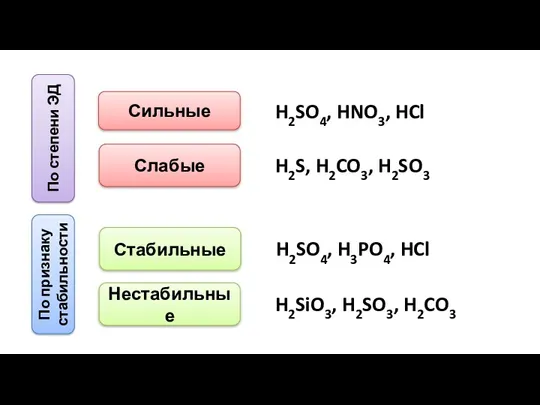
- 9. По степени ЭД Сильные Слабые H2SO4, HNO3, HCl H2S, H2CO3, H2SO3 По признаку стабильности Стабильные Нестабильные
- 10. Реакция с основаниями Кислота + основание = соль + вода NaOH + HCl = NaCl +
- 11. Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а
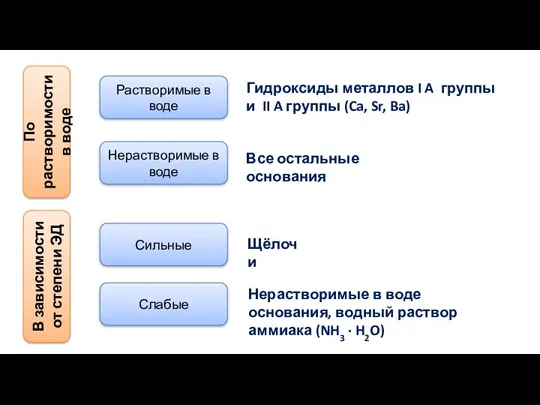
- 12. По растворимости в воде Растворимые в воде Нерастворимые в воде Гидроксиды металлов I A группы и
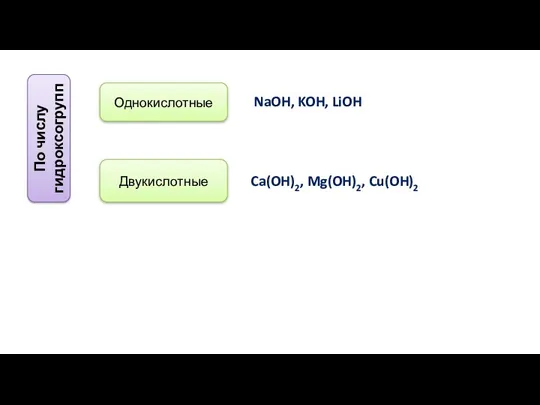
- 13. По числу гидроксогрупп Однокислотные Двукислотные NaOH, KOH, LiOH Ca(OH)2, Mg(OH)2, Cu(OH)2
- 14. Реакции оснований с кислотами (реакции обмена) Основание + кислота = соль + вода NaOH + HCl
- 15. Na2CO3 – карбонат натрия Al2(SO4)3 – сульфат алюминия Ba(NO3)2 – нитрат бария CaCl2 – хлорид кальция
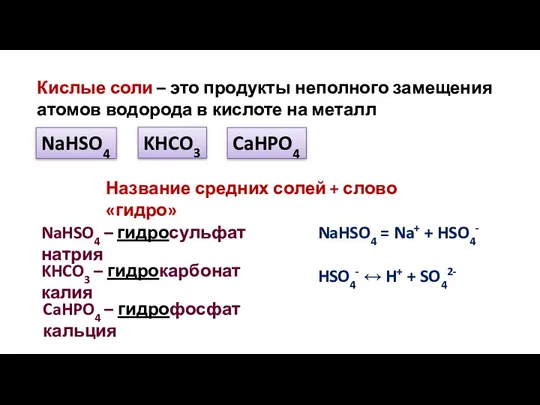
- 16. Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл NaHSO4 KHCO3 CaHPO4
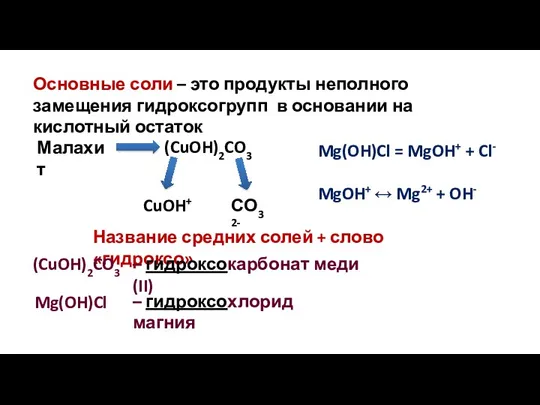
- 17. Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток (CuOH)2CO3 Малахит CuOH+
- 18. Реакция солей с кислотами Соль + кислота = новая соль + новая кислота Na2SiO3 + H2SO4
- 19. Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 Fe3+ + 3OH- = Fe(OH)3↓ (NH4)2SO4 + 2KOH =
- 20. Реакция солей с металлами Соль + металл = другая соль + другой металл
- 22. Скачать презентацию









 Инфекционные заболевания и их классификация
Инфекционные заболевания и их классификация Экологическая безопасность как основа ЗОЖ
Экологическая безопасность как основа ЗОЖ Религия, мировые религии
Религия, мировые религии Контроль качества шероховатости поверхности при различных видах обработки
Контроль качества шероховатости поверхности при различных видах обработки Nice to meet you!
Nice to meet you! Богатства, отданные людям
Богатства, отданные людям Значение транспортного законодательства для страхования грузов и транспортных средств
Значение транспортного законодательства для страхования грузов и транспортных средств Исторические личности IX-XVII веков
Исторические личности IX-XVII веков Экологическая акция Ёлочка, живи!
Экологическая акция Ёлочка, живи! КТД Новогодняя открытка своими руками Новогодний хоровод
КТД Новогодняя открытка своими руками Новогодний хоровод Орфограмма в корне. Готовимся к ГИА
Орфограмма в корне. Готовимся к ГИА Вирус иммунодефицита (ВИЧ
Вирус иммунодефицита (ВИЧ Степенная функция
Степенная функция Альпийские виды лыжного спорта. Скоростной спуск
Альпийские виды лыжного спорта. Скоростной спуск Организация перевозок и управления на транспорте (по видам)
Организация перевозок и управления на транспорте (по видам) Требования безопасности при эксплуатации сосудов, работающих под давлением
Требования безопасности при эксплуатации сосудов, работающих под давлением Типы общественных зданий
Типы общественных зданий терминальные состояния
терминальные состояния Построение (формы) музыки
Построение (формы) музыки Шұжық өндірісі
Шұжық өндірісі Каждой пичужке - моя кормушка
Каждой пичужке - моя кормушка Наш посёлок - Мизур Диск
Наш посёлок - Мизур Диск По одёжке встречают.
По одёжке встречают. Проект Лента Мёбиуса
Проект Лента Мёбиуса Информационный проект Чесма. История морского сражения
Информационный проект Чесма. История морского сражения Конкурс Хочу учиться так! Семинар мечты Финмонополия
Конкурс Хочу учиться так! Семинар мечты Финмонополия Развитие представлений о возникновении жизни на Земле
Развитие представлений о возникновении жизни на Земле Стили речи
Стили речи