Содержание
- 2. 1. Вводные 2.Уроки изучения нового материала 3.Уроки формирования умений 4.Уроки контроля и коррекции 5.Комбинированные уроки 6.Уроки
- 3. Комбинированные уроки (смешанные) 1.Самые распространенные (75 -80%); 2. Включают все основные элементы обучения в своей структуре;
- 4. Уроки изучения нового материала Используются для передачи объемов материала. Демонстрации технологических процессов, новых явлений; Формы уроков:
- 5. Урок по изучению нового материала представлен в виде презентации по теме »Коксохимическое производство»
- 6. Коксохимическое производство. Работу подготовила: Ученица 10 класс Средней школы №71 Жирякова Татьяна.
- 7. Основным сырьём для коксохимической промышленности служат угли. Структура и строение углей могут быть изучены при помощи
- 8. Кокс - это один из главных сырьевых материалов, используемых в доменном процессе. Кокс используется как источник
- 9. В углях можно различить более или менее однородную блестящую массу (витрен), сероватую массу (дюрен), содержащую различные
- 10. Качество полученного кокса зависит в значительной мере от подготовки углей и правильности составления угольной шихты. На
- 11. Коксохимические заводы сооружаются, как правило, вблизи металлургических заводов и входят в их состав, либо как отдельные
- 12. Большое народнохозяйственное значение имеют химические продукты, получающиеся при коксовании угля. Несмотря на быстрые темпы развития нефтехимической
- 13. Коксохимическая промышленность поставляет сельскому хозяйству ценное удобрение — сульфат аммония. Кроме того, на базе водорода коксового
- 14. Изучение новой темы «Типы химических реакций»
- 15. Химические реакции Учебная презентация
- 16. Типы химических реакций По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению
- 17. По числу вступивших в реакцию веществ
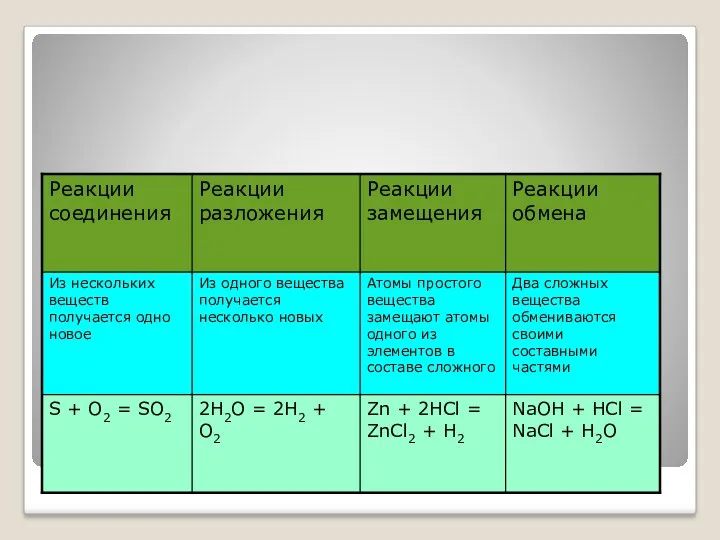
- 18. По тепловому эффекту Экзотермические Идут с выделение теплоты S + O2 = SO2 + Q Эндотермические
- 19. По обратимости Необратимые Идут только в одном направлении Условия: образование осадка или слабого электролита (Н2О), выделение
- 20. По изменению степени окисления Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 Окислительно
- 21. По механизму Ионные NaOH + HCl = NaCl + H2O Na+ + OH- + H+ +Cl-
- 22. По агрегатному состоянию веществ Гомогенные Между веществами нет поверхности раздела фаз H2 + Cl2 = 2HCl
- 23. Урок формирования новых знаний и умений Задачи уроков направлены на: - развитие и формирование умений и
- 24. Урок совершенствования новых знания Карточки с заданиями Сообщения по теме Практические работы Самостоятельные работы Презентации Видеоролики
- 25. Нестандартные уроки КВН Викторины Деловые, ролевые и интеллектуальные игры Общественные смотры знаний
- 26. Ролевая игра «Суд над алканами»
- 28. Скачать презентацию
























 Гармония. Адаптивная физическая культура
Гармония. Адаптивная физическая культура Правописание Н и НН в суффиксах имен прилагательных
Правописание Н и НН в суффиксах имен прилагательных Электронные ключи
Электронные ключи Ввод и обработка цифровой информации
Ввод и обработка цифровой информации Загрязнение атмосферы и Мирового океана
Загрязнение атмосферы и Мирового океана Документационное обеспечение управления
Документационное обеспечение управления ГТД наземного и морского применения
ГТД наземного и морского применения Маркетингова товарна політика
Маркетингова товарна політика Моя профессия педагог-психолог
Моя профессия педагог-психолог Умный мозг. Интеллектуальная игра
Умный мозг. Интеллектуальная игра Тұтас құймалы темірбетон ғимараттарды тұрғызу технологиясызу технологиясы
Тұтас құймалы темірбетон ғимараттарды тұрғызу технологиясызу технологиясы Природные ресурсы
Природные ресурсы Нейротоксические побочные реакции при применении противотуберкулезных препаратов
Нейротоксические побочные реакции при применении противотуберкулезных препаратов Френсис Дрейк - пират его величества
Френсис Дрейк - пират его величества Математическая игра Морской бой для 5-6 классов
Математическая игра Морской бой для 5-6 классов Управление денежными потоками
Управление денежными потоками презентация ко дню матери
презентация ко дню матери Совместная деятельность
Совместная деятельность КПД теплового двигателя
КПД теплового двигателя Автоматизация расчета припусков и операционных размеров. Методы определения припусков
Автоматизация расчета припусков и операционных размеров. Методы определения припусков Педагогическое кредо тренера преподавателя по борьбе самбо
Педагогическое кредо тренера преподавателя по борьбе самбо Путешествие на машине времени (история транспорта)
Путешествие на машине времени (история транспорта) Легкая промышленность зарубежной Европы
Легкая промышленность зарубежной Европы Оценка ресурсного потенциала
Оценка ресурсного потенциала Әлемдік діндер
Әлемдік діндер Наше радио
Наше радио Арбитраж. 9 поток
Арбитраж. 9 поток Отопление, водоснабжение, водоотведение, кондиционирование для профессионалов
Отопление, водоснабжение, водоотведение, кондиционирование для профессионалов