Содержание
- 2. КС– это такие соединения, в узлах кристаллической решётки которых находятся комплексы или комплексные ионы, способные к
- 3. Примеры реакций комплексообразования HgI2 + 2KI = K2[HgI4] KF + BF3 = K[BF4] Al(OH)3+ NaOH =
- 4. Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 ∙ Н2О Н - связь Примеры нейтральных комплексных соединений [Pt(NH3)2 Cl2 ]0 [Ni(CO)4]
- 5. Альфред Вернер Швейцарский химик, 1893г
- 6. Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3 Центральный атом Лиганды Внутреняя сфера Внешняя сфера Координационное число
- 7. Характеристика центрального атома Комплексообразующая способность элементов f > d > p > s
- 8. Важнейшие характеристики центрального атома : Степень окисления Координационное число Ионный потенциал
- 9. Степень окисления Положительная K3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4] Отрицательная [N -3H4 ] Cl Нулевая [Cl2(H2O)4]
- 10. Координационное число (КЧ) Это число атомов или групп атомов, непосредственно связанных с центральным атомом
- 11. - от размеров центрального атома и лигандов. Лат. liganda -то, что должно быть связано КЧ зависит:
- 12. Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм
- 13. Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм
- 14. - от степени окисления центрального атома:
- 15. К.ч. устойчивого комплекса, как правило, в два раза больше степени окисления ц.а. КЧ = 2Z Эмпирическое
- 16. Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6] - концентрации исходных компонентов :
- 17. Характеристика лигандов
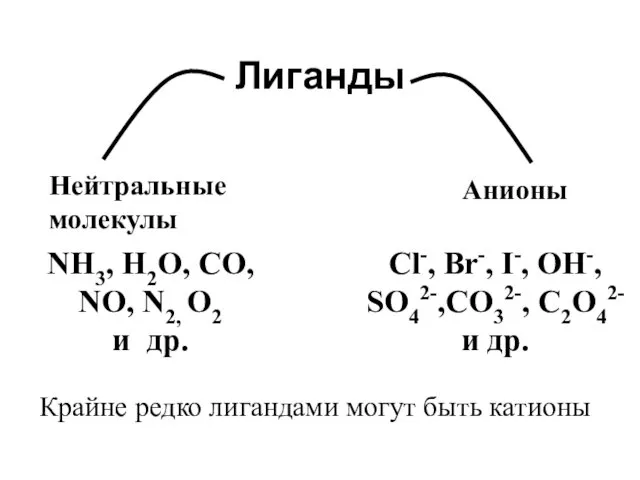
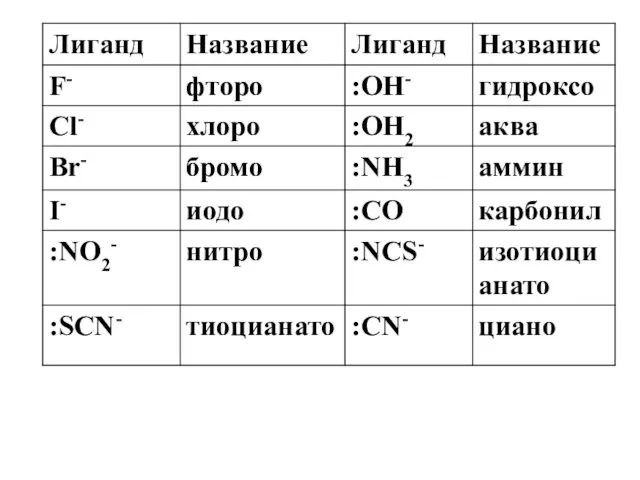
- 18. Лиганды NH3, H2O, CO, NO, N2, O2 и др. Cl-, Br-, I-, OH-, SO42-,CO32-, C2O42- и
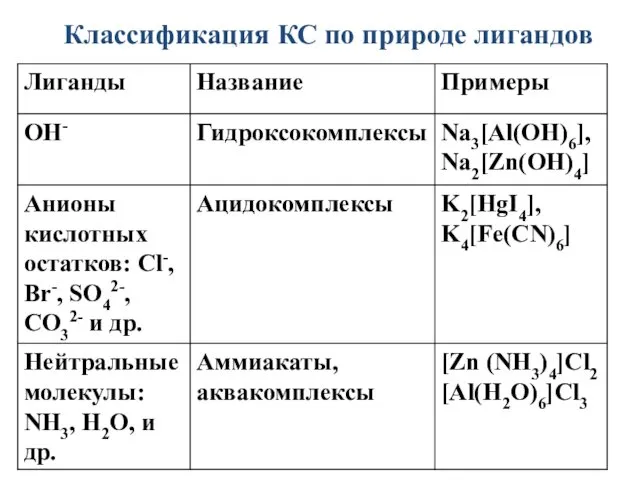
- 19. Классификация КС по природе лигандов
- 20. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-) Число донорных атомов в
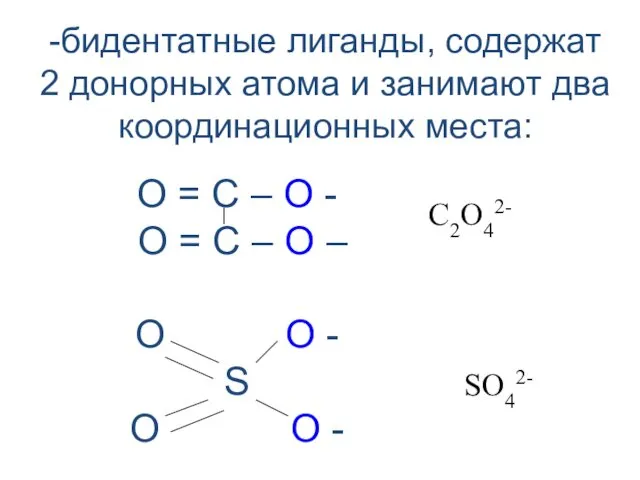
- 21. -бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О
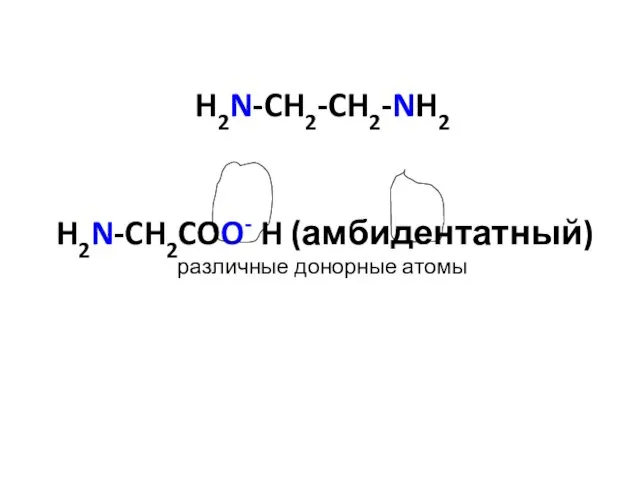
- 22. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
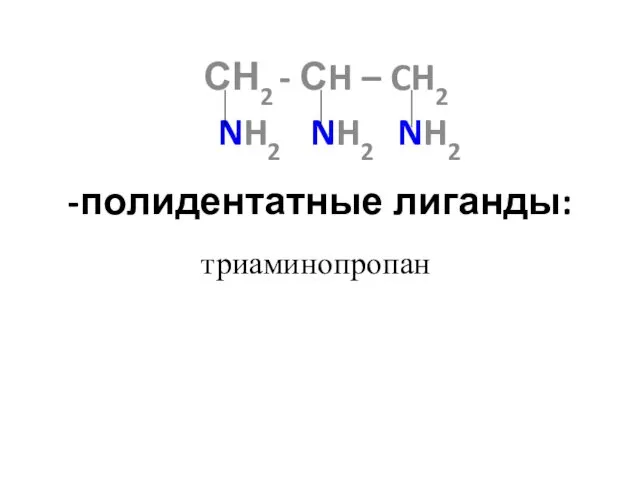
- 23. -полидентатные лиганды: СН2 - СH – CH2 NH2 NH2 NH2 триаминопропан
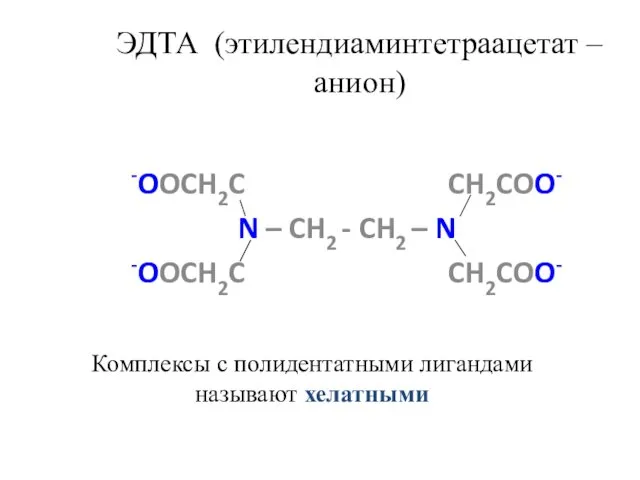
- 24. ЭДТА (этилендиаминтетраацетат –анион) -OOCH2C CH2COO- N – CH2 - CH2 – N -OOCH2C CH2COO- Комплексы с
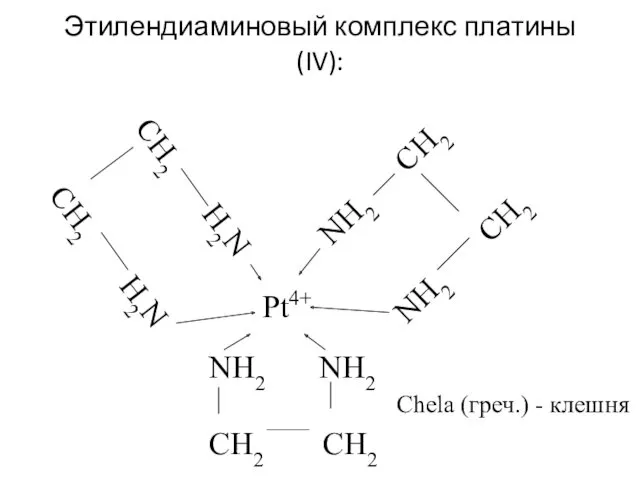
- 25. Этилендиаминовый комплекс платины(IV): Chela (греч.) - клешня
- 26. Природа химической связи в комплексных соединениях
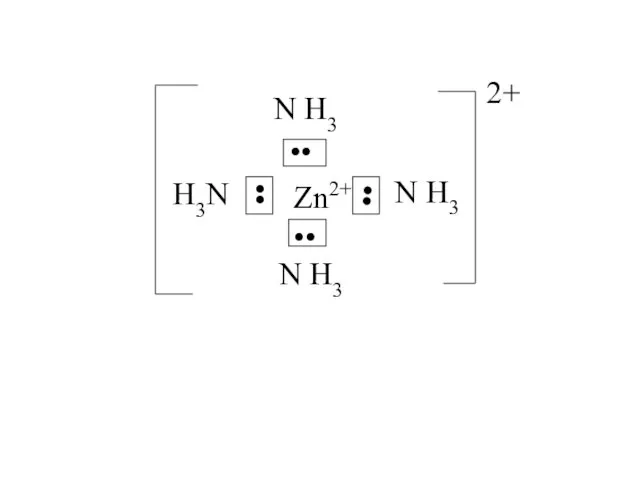
- 27. Zn2+ + 4 NH3 →[Zn(NH3)4]2+
- 28. Zn0:1s22s22p63s23p64s23d104p0 Zn2+:1s22s22p63s23p64s03d104p0 3d 4s 4p Zn2+: •• •• •• •• [ Zn (NH3)4]2+ sp3
- 29. 3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+ •• •• d2sp3
- 30. Zn2+ •• •• •• •• N H3 N H3 N H3 H3N 2+
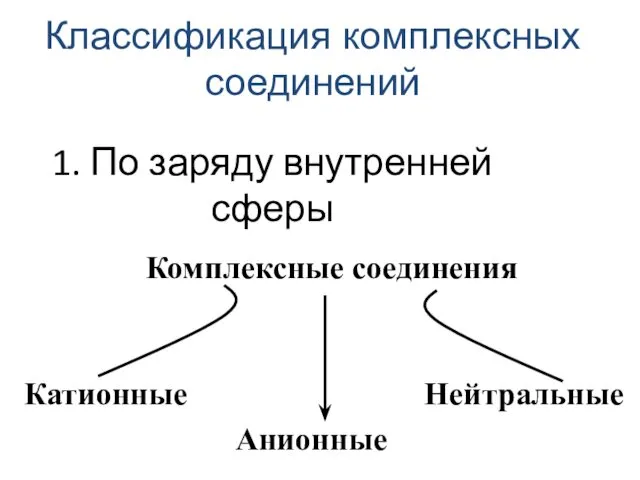
- 31. 1. По заряду внутренней сферы Классификация комплексных соединений
- 32. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-
- 33. 2. По природе лиганда: Гидроксокомплексы ( ОН-) Аквакомплексы (Н2О) Аммиакатные комплексы (NH3) Ацидокомплексы ( CN- -
- 34. Номенклатура комплексных соединений
- 36. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2 Сульфат тетраамминмеди (II) Гексанитрокобальтат (III) натрия Дихлородиамминплатина Бромид хлородиакватриамминхрома (III)
- 37. Диссоциация комплексных соединений
- 38. K4 [Fe(CN)6] Ионная связь (диссоциация по типу сильного электролита)
- 39. K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
- 40. [Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости (Кн): Kн = 1∙10-31 (очень прочный
- 41. [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) Куст.=1/ Кн
- 42. Кн и Ку относятся только к комплексному иону! Не забывайте !
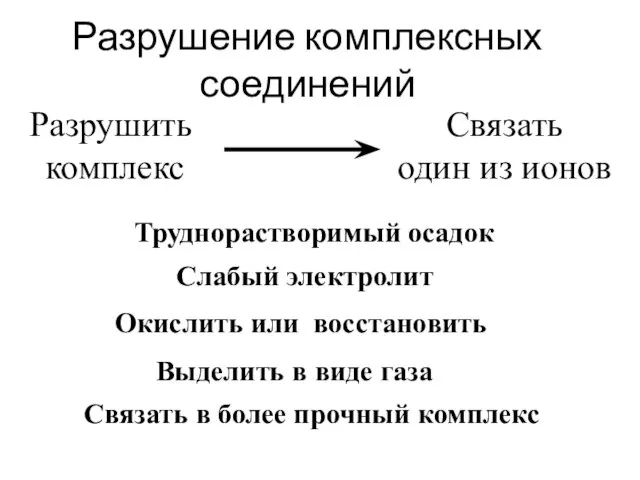
- 43. Разрушение комплексных соединений Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в
- 44. [Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8
- 45. [Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ ПРAgI = 1,5·10 -16 [Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3 Кн
- 46. [Ag (NH3)2]+↔ Ag+ + 2 NH3
- 47. Биологическая роль комплексных соединений
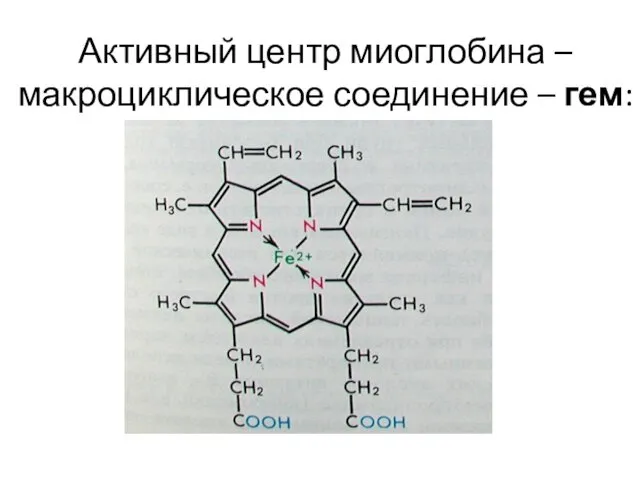
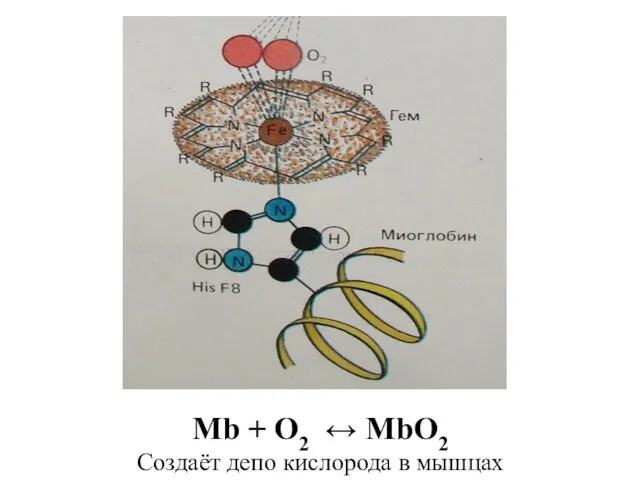
- 48. Активный центр миоглобина – макроциклическое соединение – гем:
- 49. Mb + O2 ↔ MbO2 Создаёт депо кислорода в мышцах
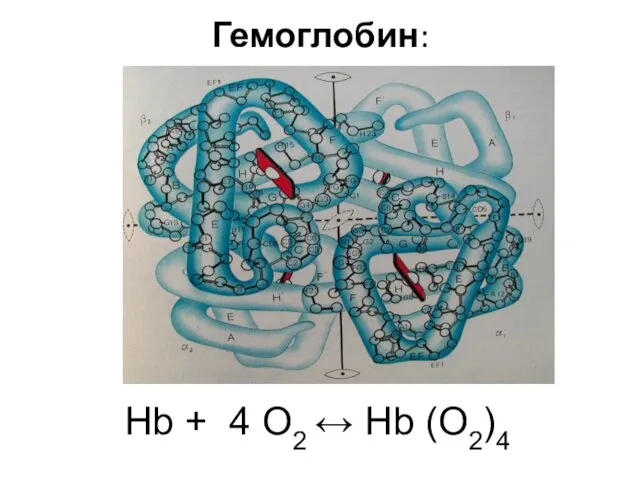
- 50. Гемоглобин: Hb + 4 O2 ↔ Hb (O2)4
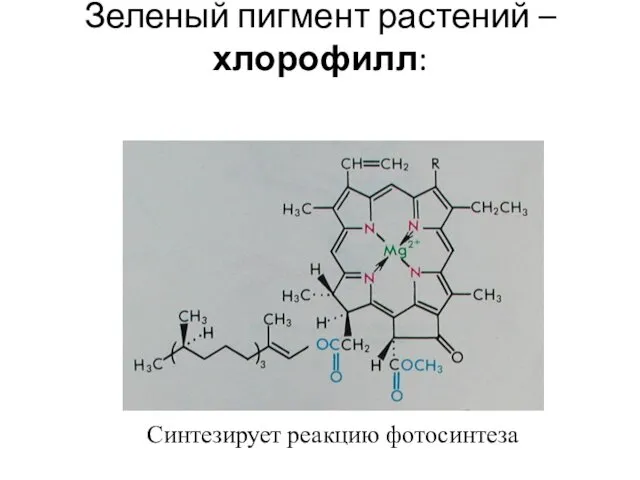
- 51. Зеленый пигмент растений –хлорофилл: Синтезирует реакцию фотосинтеза
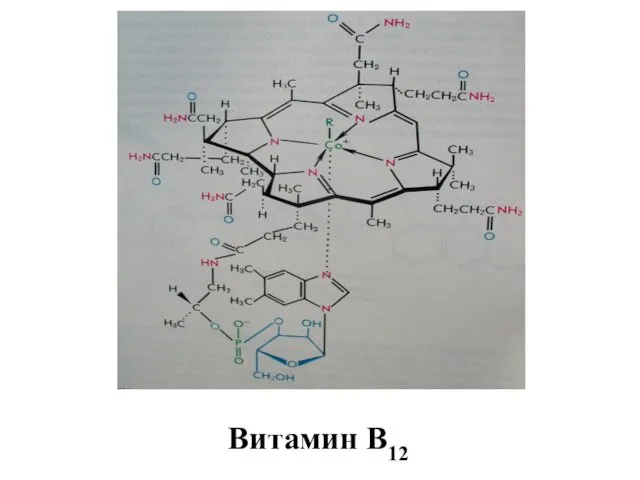
- 52. Витамин В12
- 53. Применение комплексных соединений в медицине
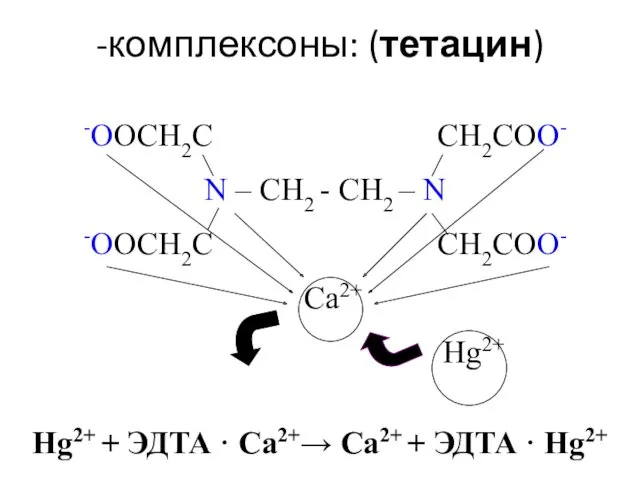
- 54. -комплексоны: (тетацин) -OOCH2C CH2COO- N – CH2 - CH2 – N -OOCH2C CH2COO- Сa2+ Hg2+ Hg2+
- 55. -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]
- 57. Скачать презентацию

![Примеры реакций комплексообразования HgI2 + 2KI = K2[HgI4] KF +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-2.jpg)
![Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 ∙ Н2О Н - связь Примеры нейтральных комплексных соединений [Pt(NH3)2 Cl2 ]0 [Ni(CO)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-3.jpg)

![Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3 Центральный атом Лиганды Внутреняя сфера Внешняя сфера Координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-5.jpg)


![Степень окисления Положительная K3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4] Отрицательная [N -3H4 ] Cl Нулевая [Cl2(H2O)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-8.jpg)


![Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-11.jpg)
![Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-12.jpg)


![Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6] - концентрации исходных компонентов :](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-15.jpg)



![Zn2+ + 4 NH3 →[Zn(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-26.jpg)
![Zn0:1s22s22p63s23p64s23d104p0 Zn2+:1s22s22p63s23p64s03d104p0 3d 4s 4p Zn2+: •• •• •• •• [ Zn (NH3)4]2+ sp3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-27.jpg)
![3d 4s 4p Cr3+: •• •• •• •• [Cr(H2O)6 ]3+ •• •• d2sp3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-28.jpg)
![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-31.jpg)


![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2 Сульфат тетраамминмеди (II) Гексанитрокобальтат (III) натрия Дихлородиамминплатина Бромид хлородиакватриамминхрома (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-35.jpg)

![K4 [Fe(CN)6] Ионная связь (диссоциация по типу сильного электролита)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-37.jpg)
![K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-38.jpg)
![[Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-39.jpg)
![[Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) Куст.=1/ Кн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-40.jpg)

![[Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-43.jpg)
![[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ ПРAgI = 1,5·10 -16](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-44.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-45.jpg)


![-противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43558/slide-54.jpg)
 Дом детского творчества Вятскополянского района
Дом детского творчества Вятскополянского района Расскажите о себе. Дневник участника
Расскажите о себе. Дневник участника Пионеры-герои в Великой Отечественной войне
Пионеры-герои в Великой Отечественной войне Газовые законы
Газовые законы Безопасность в чрезвычайных ситуациях
Безопасность в чрезвычайных ситуациях География. Транспорт России
География. Транспорт России Базовые конкурентные стратегии
Базовые конкурентные стратегии Иван Иванович Шишкин
Иван Иванович Шишкин АҚҚ (АПВ). Қарапайым бір реттік АПВ желісінің жұмыс
АҚҚ (АПВ). Қарапайым бір реттік АПВ желісінің жұмыс Tsvetnye_figury_-_interaktivnaya_igra
Tsvetnye_figury_-_interaktivnaya_igra Роль артикуляционной гимнастики в речевом развитии детей
Роль артикуляционной гимнастики в речевом развитии детей Великая Отечественная Война
Великая Отечественная Война Традиции и современность. 100 – летие дополнительного образования в Российской Федерации
Традиции и современность. 100 – летие дополнительного образования в Российской Федерации Алые паруса. Александр Степанович Грин
Алые паруса. Александр Степанович Грин Еще одна прекрасная церковь_БОУ СОШ6
Еще одна прекрасная церковь_БОУ СОШ6 Педагогический соцпроект Наследие и наследники
Педагогический соцпроект Наследие и наследники Внеурочной деятельности Ух, ты! Масленица.
Внеурочной деятельности Ух, ты! Масленица. Оптическое прозрачное тело - линза
Оптическое прозрачное тело - линза Падежные окончания имен существительных
Падежные окончания имен существительных Устройство карпового прудового рыбхоза
Устройство карпового прудового рыбхоза Жүкті әйелдерің босану алдында жүргізілетін
Жүкті әйелдерің босану алдында жүргізілетін Робототехника прошлого и будущего
Робототехника прошлого и будущего Зажимные механизмы и элементы приспособлений
Зажимные механизмы и элементы приспособлений Презентация к уроку Знаний Моя малая Родина 2класс
Презентация к уроку Знаний Моя малая Родина 2класс Антихолинэстеразные средства
Антихолинэстеразные средства Влияние тестопластики на общие развитие детей младшего дошкольного возраста
Влияние тестопластики на общие развитие детей младшего дошкольного возраста Загадки о космосе
Загадки о космосе Государство и право Англии в средние века
Государство и право Англии в средние века