Содержание
- 2. Проблема «дополнительных валентностей» CuSO4.4NH3 – Андрей Либавий, 1597 г. AgCl.2NH3 – И. Глаубер, 1648 г. CoCl3.6NH3
- 3. Двойная соль или комплексное соединение? KCr(SO4)2∙ 12H2O – хромокалиевые квасцы KCr(SO4)2∙ 12H2O = = K+ +
- 4. Теория Бломстранда - Иёргенсона К. В. Бломстранд (1826-1897), профессор университета в Лунде, 1869 г. «Современная химия»
- 5. Валентность постоянная или переменная? «Соединительная сила» Эдуард Франкланд, 1852 г. «Атомность» «Валентность» Г. Вихельгауз, 1868 г.
- 6. Цепь аммиаков может быть, по-видимому, беспредельна, и, нам кажется, наиболее существенный недостаток такого представления и состоит
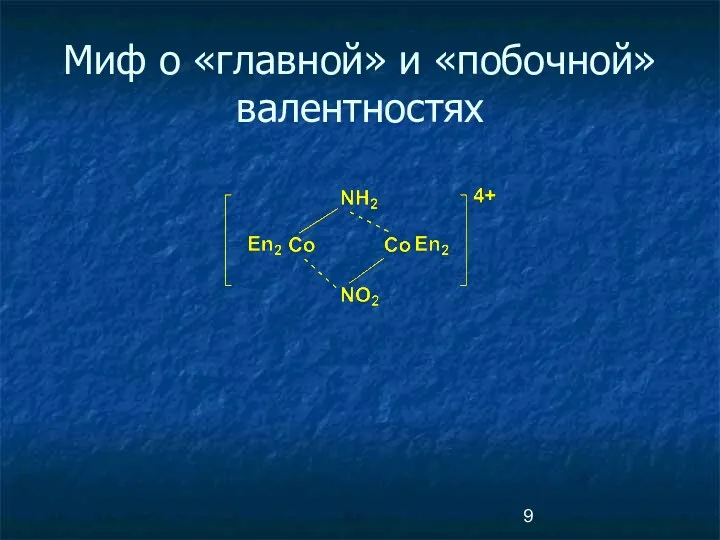
- 7. Рождение координационной теории Альфред Вернер «К вопросу о строении неорганических соединений». 1893 г. Главная и побочная
- 8. Главная и побочная валентности PtCl4.2NH3 Pt Cl Cl Cl Cl NH3 NH3 Главная валентность соответствует обычной
- 9. Миф о «главной» и «побочной» валентностях
- 10. Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера [Cu(NH3)4]Cl2
- 11. Рождение стереохимии Якоб Вант-Гофф (1852 — 1912) 1874 г. «Предложение применять в пространстве современные структурно-химические формулы
- 12. Строение комплексного соединения K3 [Fe(CN)6] [Cu(NH3)4]Cl2 [Zn(NH3)4]Cl2
- 13. Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) +3 +2 Порядок перечисления лиганд: Анионные:
- 14. Упражнение 1 Первое основание Рейзе [Pt(NH3)4](OH)2 Соль Чугаева [PtCl(NH3)5]Cl3 Соль Цейзе K[PtCl3C2H4] Пурпуреосоль [CoCl(NH3)5]Cl2 Кроцеосоль [Co(NO2)2(NH3)4]Cl
- 15. Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диамминсеребра(I) [Ag(NH3)2]OH реактив Толленса Тетраиодомеркурат(II) калия K2[HgI4] реактив Несслера Тетрароданомеркурат(II)
- 17. Вернер подтверждает Вернера 1893-4 гг. не были периодом утверждения теории. Вернер 20 лет не оставлял лаборатории
- 18. Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2 4 [Pt(NH3)3Cl3]Cl 5 [Pt(NH3)2Cl4] 6 K[Pt(NH3)Cl5]
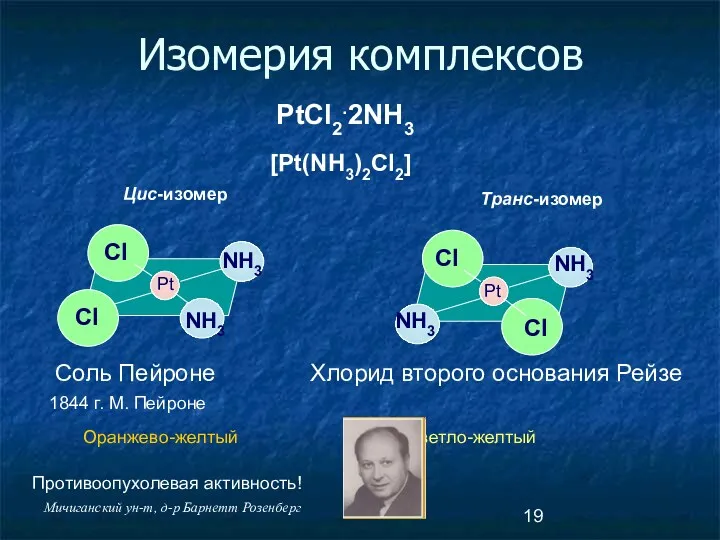
- 19. Изомерия комплексов PtCl2.2NH3 Pt Pt Cl Cl Cl Cl NH3 NH3 NH3 NH3 Соль Пейроне Хлорид
- 20. Сольватная изомерия
- 21. Механизм образования комплексного иона [Al(OH)4]-
- 22. Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3- [Cu(NH3)4]SO4 = [Cu(NH3)4]2+
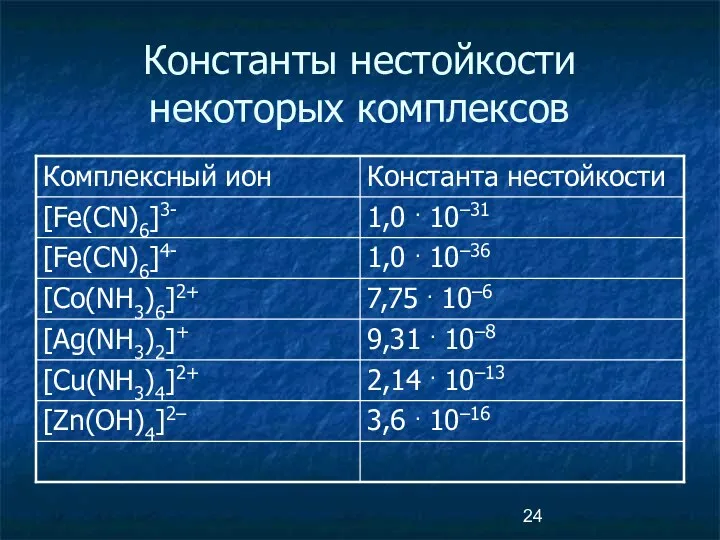
- 23. Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag+] [NH3]2 KH = =
- 24. Константы нестойкости некоторых комплексов
- 25. Что же такое комплексы? Комплексные соединения – вещества, существующие как в кристаллическом состоянии, так и в
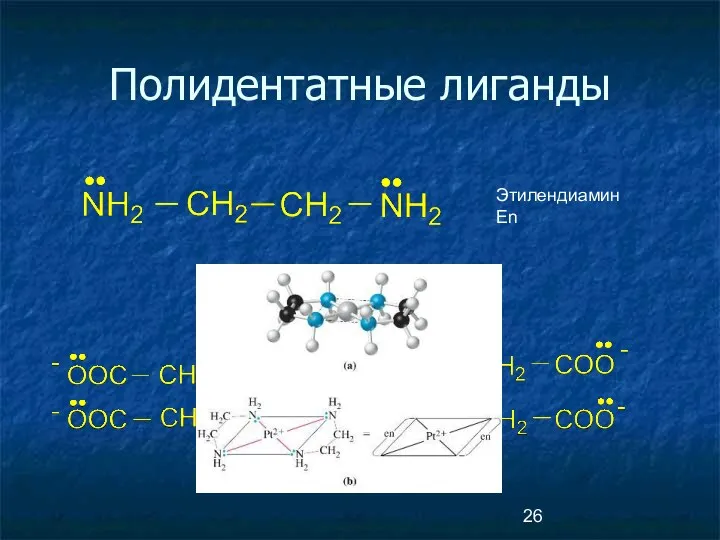
- 26. Полидентатные лиганды ЭДТА Этилендиамин En
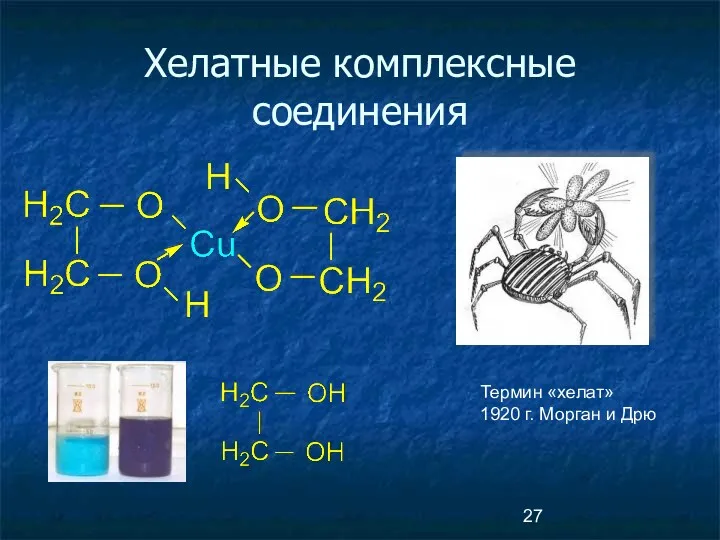
- 27. Хелатные комплексные соединения Термин «хелат» 1920 г. Морган и Дрю
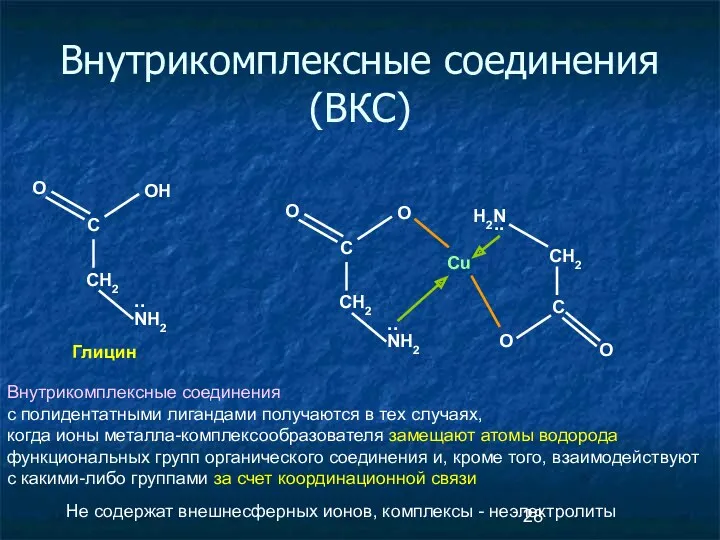
- 28. Внутрикомплексные соединения (ВКС) CH2 С OH NH2 .. Глицин O Cu CH2 С O NH2 ..
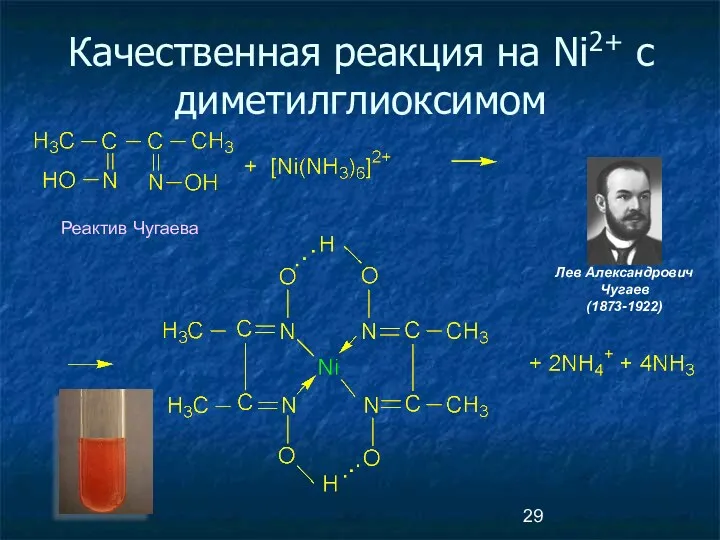
- 29. Качественная реакция на Ni2+ c диметилглиоксимом Реактив Чугаева Лев Александрович Чугаев (1873-1922)
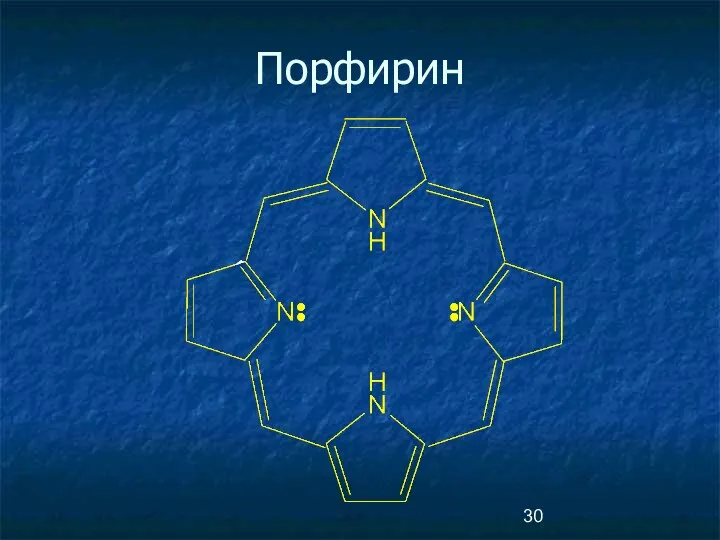
- 30. Порфирин
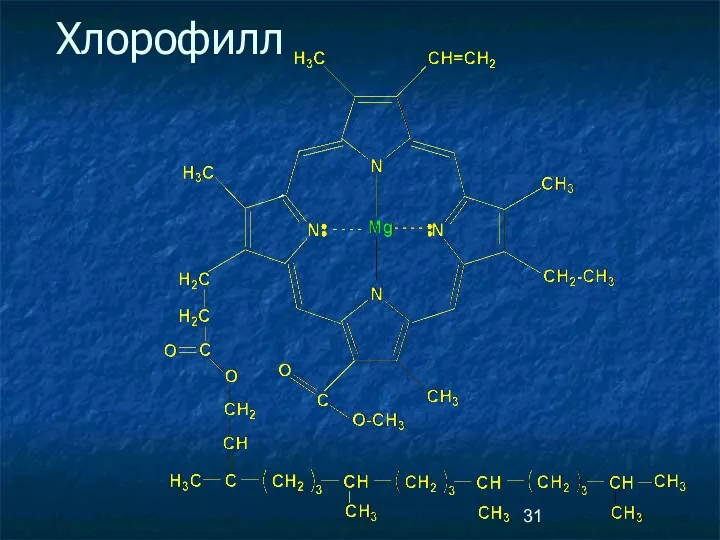
- 31. Хлорофилл
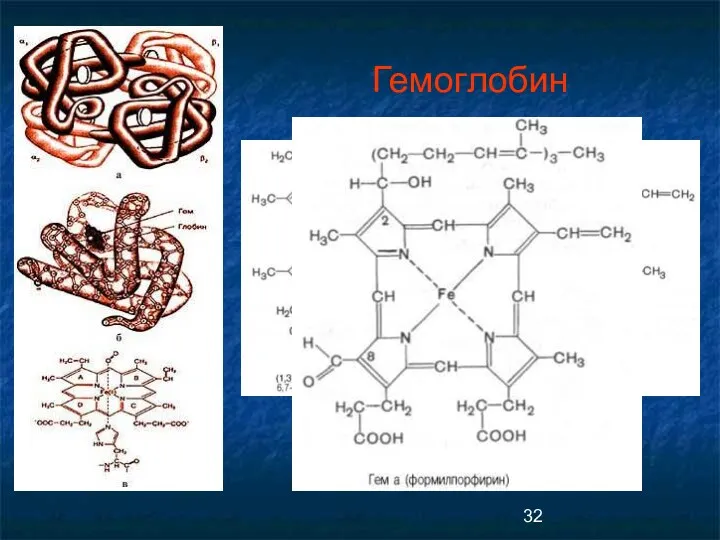
- 32. Гемоглобин
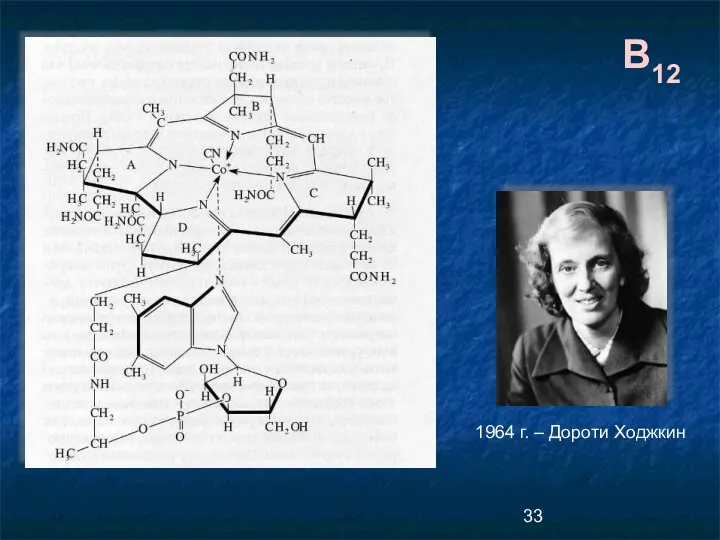
- 33. B12 1964 г. – Дороти Ходжкин
- 34. Альфред Вернер 1866-1919 1866 г. – родился в Мюлузе (Эльзас)
- 35. 1891 г. – конкурсная работа на звание приват-доцента «К теории сродства и валентности» 1891 г –
- 36. Альфред Вернер 1866-1919 В 1913 г. шведский король Густав V вручил Альфреду Вернеру золотую медаль лауреата
- 37. Спасибо за внимание!
- 39. Скачать презентацию







![Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-9.jpg)

![Строение комплексного соединения K3 [Fe(CN)6] [Cu(NH3)4]Cl2 [Zn(NH3)4]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-11.jpg)
![Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-12.jpg)
2 Соль Чугаева [PtCl(NH3)5]Cl3 Соль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-13.jpg)
![Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диамминсеребра(I) [Ag(NH3)2]OH реактив Толленса](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-14.jpg)


![Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-17.jpg)

![Механизм образования комплексного иона [Al(OH)4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-20.jpg)
![Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-21.jpg)
![Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/450028/slide-22.jpg)




 Осложнения при бурении в глинистых породах. Лекция 5
Осложнения при бурении в глинистых породах. Лекция 5 Чувства на цехе. Как я, организатор и человек, проходивший цех, вижу цех изнутри
Чувства на цехе. Как я, организатор и человек, проходивший цех, вижу цех изнутри Устные приёмы умножения и деления чисел
Устные приёмы умножения и деления чисел История русского фарфора. Классический период
История русского фарфора. Классический период Изобразительно-выразительные средства в литературе. Тропы
Изобразительно-выразительные средства в литературе. Тропы Соединение деталей вполдерева
Соединение деталей вполдерева Живое вещество и его функции
Живое вещество и его функции Презентация Сыйфат
Презентация Сыйфат Родители и дети
Родители и дети Реконструкция подстанции 35/10 кВ Атяшевская путем замены коммутационной аппаратуры
Реконструкция подстанции 35/10 кВ Атяшевская путем замены коммутационной аппаратуры Морокко. Столица: Рабат
Морокко. Столица: Рабат Работа с грантами
Работа с грантами Социальная стратификация социалистического общества
Социальная стратификация социалистического общества Родительское собрание по теме Внимание.Презентация.
Родительское собрание по теме Внимание.Презентация. Деревья и кустарники
Деревья и кустарники Медиакит радио GOLDSTAR
Медиакит радио GOLDSTAR Пять видов аутентификации и где они обитают
Пять видов аутентификации и где они обитают Принципы объектно-ориентированного дизайна
Принципы объектно-ориентированного дизайна Бронхтал құрылысы
Бронхтал құрылысы Определение параллельных прямых. Секущая. Углы, образованные при пересечении двух прямых секущей
Определение параллельных прямых. Секущая. Углы, образованные при пересечении двух прямых секущей Организация и программная модель однокристальных 16-разрядных микропроцессоров
Организация и программная модель однокристальных 16-разрядных микропроцессоров Поволжский экономический район
Поволжский экономический район Игры в Кавказских пленников и Робинзонов в рассказах Саши Чёрного
Игры в Кавказских пленников и Робинзонов в рассказах Саши Чёрного Arthur Conan Doyle
Arthur Conan Doyle Понятие и сущность маркетинга
Понятие и сущность маркетинга phpOdviwa_rozhdestvo
phpOdviwa_rozhdestvo Темперамент, характер, способности
Темперамент, характер, способности Проектная работа обучающихся 7 класса Тайны Бермудского треугольника
Проектная работа обучающихся 7 класса Тайны Бермудского треугольника