Содержание
- 2. Решаем загадки «Неметалы» Красив в кристаллах и парах, на детей наводит страх. Белый, воздуха боится, покраснел
- 3. Решаем загадки «Неметалы» Гость из космоса пришёл, в воздухе приют себе нашёл. Какой газ утверждает, что
- 4. Сера - химический элемент Каков химический знак? В какой группе периодической системы находится? В каком периоде
- 5. Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и
- 6. Сера также встречается в виде сульфатов солей серной кислоты - мирабилит Сера также встречается в виде
- 7. Пирит - огненный камень (соединение серы в природе)
- 8. Сера - жизненно важный химический элемент Сера входит в состав белков. Особенно много серы в белках
- 9. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.
- 10. Физические свойства Твёрдое кристаллическое вещество желтого цвета, без запаха. Как и все неметаллы плохо проводит теплоту
- 11. Применение серы Серу применяют для производства : Серной кислоты Вулканизации каучука Фунгицида в сельском хозяйстве Сера
- 12. Производство серной кислоты l стадия производства – обжиг: S + O2 =SO2 +297 кДж 4FeS2 +
- 13. Выход продукта- отношение массы полученного вещества к теоретически достижимой массе.
- 14. Рассмотрим пример - задачу. Сырье – пирит содержит 80% полезного вещества FeS2. При обжиге 1 т
- 15. Стихотворение «Сера» Сера, сера, сера, эс. Тридцать два - атомный вес. Сера в воздухе сгорит, Мы
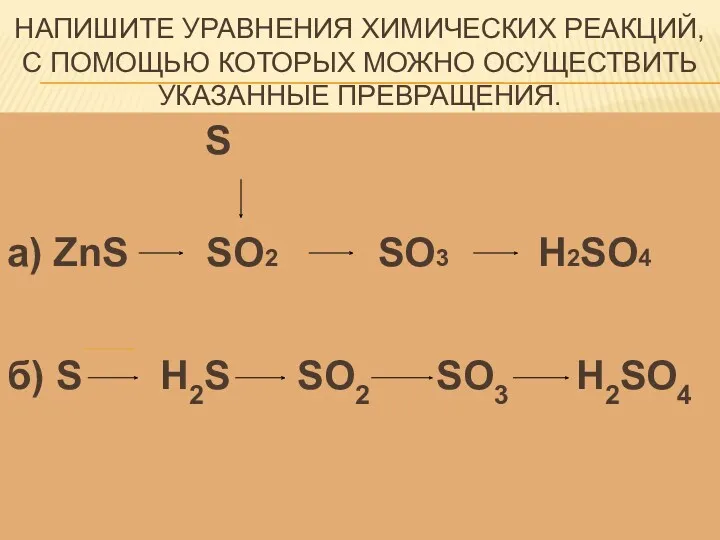
- 16. Напишите уравнения химических реакций, с помощью которых можно осуществить указанные превращения. S а) ZnS SO2 SO3
- 17. Задача: Каков объём (н.у.) а) сернистого газа получится при обжиге на воздухе 120г пирита FeS2; б)
- 18. Домашнее задание § 19.1 ; задача № 15
- 19. за внимание! Спасибо
- 21. Скачать презентацию

















 Развитие навыков связной речи первоклассников с речевыми недостатками в процессе организации творческой игровой деятельности
Развитие навыков связной речи первоклассников с речевыми недостатками в процессе организации творческой игровой деятельности Апоптоз. Механизмы апоптоза
Апоптоз. Механизмы апоптоза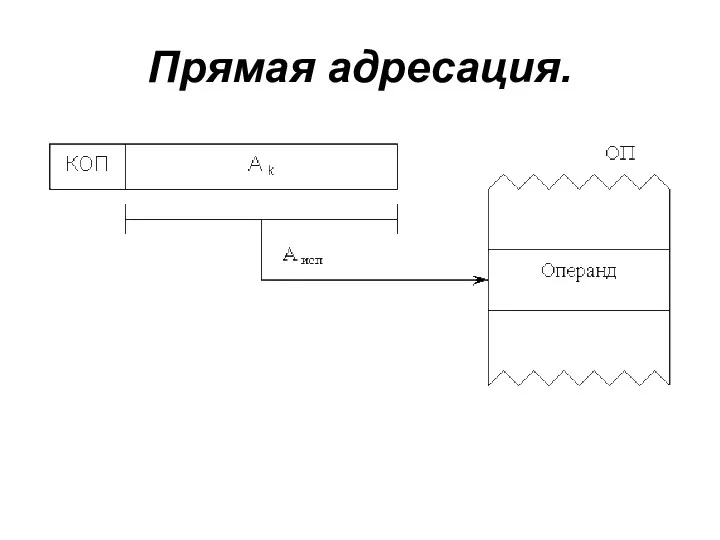 Способы адресации
Способы адресации презентация опыта
презентация опыта Государственная политика развития информационных и коммуникационных технологий
Государственная политика развития информационных и коммуникационных технологий Элементы линейной алгебры. Лекция 10
Элементы линейной алгебры. Лекция 10 20231112_7_klass_novoe_vremya_igra
20231112_7_klass_novoe_vremya_igra Как выполнить сжатие рисунков в PowerPoint и других приложениях MS Office
Как выполнить сжатие рисунков в PowerPoint и других приложениях MS Office Клиника первого и второго периода родов
Клиника первого и второго периода родов School
School ЭКО-подиум. Народы Арктики
ЭКО-подиум. Народы Арктики Методический семинар для аспирантов. Диссертация на соискание ученой степени
Методический семинар для аспирантов. Диссертация на соискание ученой степени Футболки с принтом “Jack in Prague”. Описание макета. Требования к макету
Футболки с принтом “Jack in Prague”. Описание макета. Требования к макету Никогда не сдавайся!
Никогда не сдавайся! 06.02.24 своя игра
06.02.24 своя игра ЭЛЕКТРОННОЕ ПОРТФОЛИО - Правовое образование детей дошкольного возраста (презентация)
ЭЛЕКТРОННОЕ ПОРТФОЛИО - Правовое образование детей дошкольного возраста (презентация) Учитесь властвовать собой - не попадая в плен зависимостей и привычек!
Учитесь властвовать собой - не попадая в плен зависимостей и привычек!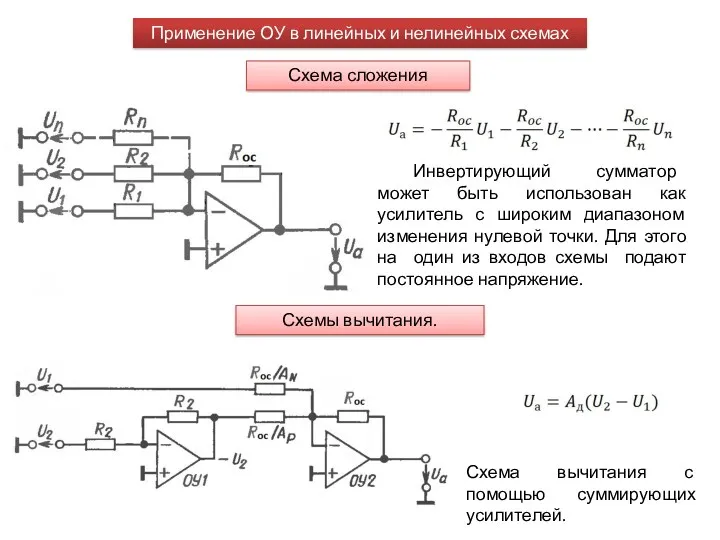 Применение ОУ в линейных и нелинейных схемах. СА1 лекция 7
Применение ОУ в линейных и нелинейных схемах. СА1 лекция 7 Балаларда стоматологиялық аурулардың антенатальді алдын алуы
Балаларда стоматологиялық аурулардың антенатальді алдын алуы Регламентация воздушных перевозок
Регламентация воздушных перевозок Предварительные понятия о православном вероучении. Понятие о Символе веры
Предварительные понятия о православном вероучении. Понятие о Символе веры Методы решения электронного уравнения Шредингера
Методы решения электронного уравнения Шредингера История создания татарского национального костюма
История создания татарского национального костюма Основы инфузионно-трансфузионной терапии
Основы инфузионно-трансфузионной терапии Пушкин Александр Сергеевич. Сказки
Пушкин Александр Сергеевич. Сказки Профилактика врожденной патологии лица. Медико-генетическое консультирование при пороках развития лица, челюстных костей
Профилактика врожденной патологии лица. Медико-генетическое консультирование при пороках развития лица, челюстных костей Приложение 2. Неразлучные друзья - взрослые и дети
Приложение 2. Неразлучные друзья - взрослые и дети колумбия
колумбия