Слайд 2

Цели урока:
- рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении
его атома;
- рассмотреть нахождение кремния в природе;
- обратить внимание на физические свойства кремния;
- рассмотреть химические свойства кремния и способы его получения.
Слайд 3
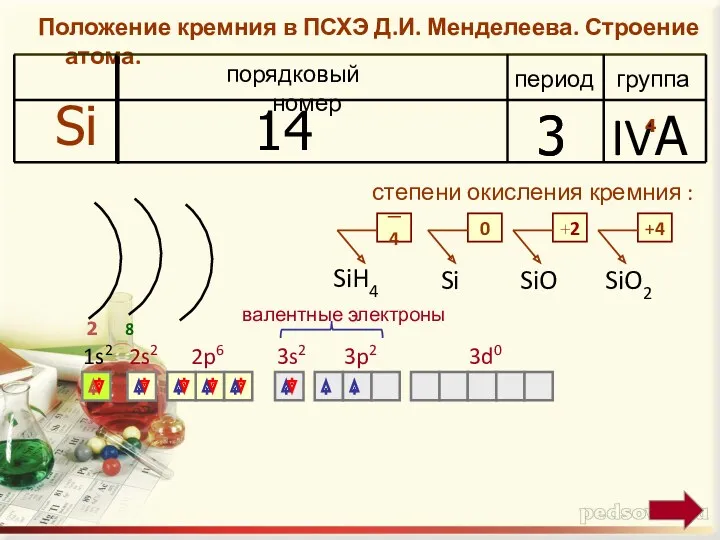
Положение кремния в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Si
14
3
IVA
3
2
4
степени окисления кремния
:
─ 4
0
+4
1s2
2s2
2p6
+2
валентные электроны
SiH4
Si
SiO
SiO2
8
3s2
3p2
3d0
Слайд 4

Слайд 5

Способы получения
Лабораторный способ получения:
Si+4O2 + 2Mg0 → 2Mg+2O + Si0
Промышленный способ
получения:
19000C
Si+4O2 + 2C0 ―――→ 2C+2O + Si0
Слайд 6

Физические свойства кремния
ρ = 2,33 г/см3
tплавления = 1415 0С
tкипения = 3500
0С
Слайд 7

Химические свойства
1) Кремний – восстановитель
Все реакции протекают при нагревании.
а) взаимодействие с
кислородом
Si0 + O20 = Si+4O2–2
Si0 -4e → Si+4 │4│1-восстановитель
O20 + 4e → 2O –2 │4│1-окислитель
б) взаимодействие с хлором
Si0 + 2Cl20 = Si+4Cl4-1
Si0 -4e → Si+4 │4 │1-восстановитель
Cl20 +2e → 2Cl- │2 │ 2-окислитель
Слайд 8

в) взаимодействие с серой
Si0 + 2S0 → Si+4S2-2
Si0 -4ē → Si+4
│2│1-восстановитель
S0 +2ē → S-2 │4│2-окислитель
г) взаимодействие с углеродом
20000С
Si0 + С0 ―――→ Si+4С-4 (карборунд)
Si0 -4e → Si + 4 │4│ 1-восстановитель
С0 +4e → С -4 │4│ 1-окислитель
Слайд 9

д) взаимодействие с водяным паром
Si0 + H2+1O (пар) → Si+4O2 +
H20↑
Si0 -4e → Si + 4│2│1-восстановитель
2H+ +2e → H20│4│2-окислитель
е) взаимодействие со щелочью
Si0 + 2NaOH + H+2O → Na2Si+4O3 + 2H20↑
Si0 -4e → Si+4 │4│1-восстановитель
2H+ +2e → H20 │2│2-окислитель
Слайд 10

2) Кремний – окислитель
Взаимодействие с металлами
Si0 + 2Mg0 = Mg2+2Si–4 (силицид
магния)
Si0 +4e → Si – 4 │2 │1-окислитель
Mg0 -2e → Mg +2│4 │2-восстановитель
Кремний напрямую не соединяется с водородом.
Силан получают косвенно, действуя на силициды металлов водой или кислотами
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑









 Эрнест Хемингуэй 1899-1961
Эрнест Хемингуэй 1899-1961 Учить жить!
Учить жить! Характеристика и проблемы младшего школьного возраста
Характеристика и проблемы младшего школьного возраста Дикие животные Крайнего Севера
Дикие животные Крайнего Севера Бақытжан Бейсалыүлы Каратаев
Бақытжан Бейсалыүлы Каратаев Освоение космоса
Освоение космоса Фотоматериалы к защите проекта Наша Древняя Москва Диск
Фотоматериалы к защите проекта Наша Древняя Москва Диск Big Date (Большие данные)
Big Date (Большие данные) Зоопарк. Охрана животных
Зоопарк. Охрана животных Автогрейдерлер
Автогрейдерлер Мастера печатных дел. 4 класс
Мастера печатных дел. 4 класс Системы открывания
Системы открывания Онтогенез
Онтогенез Мастер-класс Дымковская барыня из бросоваго материала
Мастер-класс Дымковская барыня из бросоваго материала Первые проблемы подросткового возраста
Первые проблемы подросткового возраста Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса
Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса Внеклассное мероприятие Спор трех королев
Внеклассное мероприятие Спор трех королев Посвящение Булату Окуджаве
Посвящение Булату Окуджаве Основы геодемографии
Основы геодемографии 9 Мая – День Победы !
9 Мая – День Победы ! Мобильное приложение для Вашего бизнеса
Мобильное приложение для Вашего бизнеса Шесть самых провальных строительных проектов мира. Самые большие и самые смелые проекты на планете
Шесть самых провальных строительных проектов мира. Самые большие и самые смелые проекты на планете Тип Плоские черви
Тип Плоские черви О ні, ніхто нас не розлучить з Христом
О ні, ніхто нас не розлучить з Христом L’Italia del Barocco e della scienza
L’Italia del Barocco e della scienza Практическое занятие по русскому языку для педагогов, родителей, обучающихся.
Практическое занятие по русскому языку для педагогов, родителей, обучающихся. Аппликация из ваты
Аппликация из ваты Правила написания социально-значимого проекта
Правила написания социально-значимого проекта