Содержание
- 3. Химическая коррозия Химическая коррозия – процесс разрушения металла в результате протекания гетерогенных реакций без возникновения тока
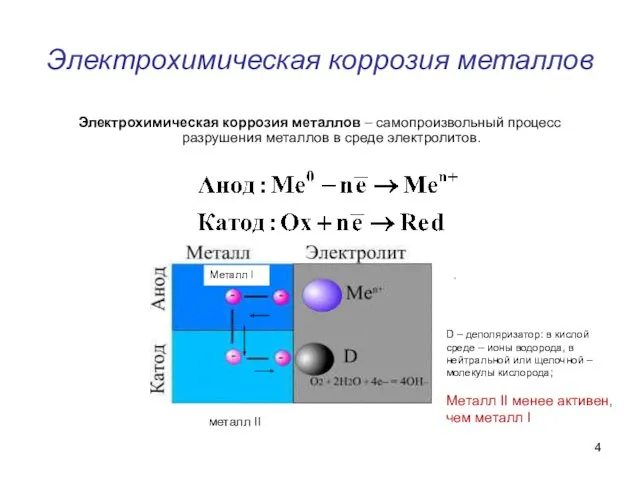
- 4. Электрохимическая коррозия металлов Электрохимическая коррозия металлов – самопроизвольный процесс разрушения металлов в среде электролитов. металл II
- 5. Катодные процессы при протекании коррозии по электрохимическому механизму
- 6. Причины электрохимической коррозии
- 7. Так как то контакт двух разных металлов приводит к тому, что разрушаться будет железо: Контакт двух
- 8. Образующийся гидроксид железа (II) подвергается последующему окислению: Контакт двух разных металлов (щелочная и нейтральная среды)
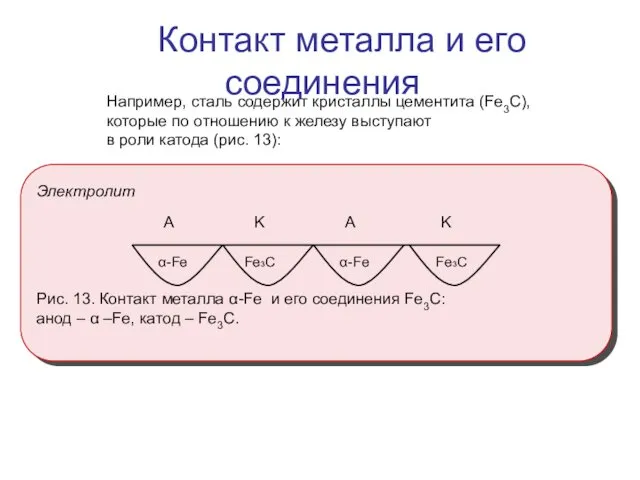
- 9. Например, сталь содержит кристаллы цементита (Fe3C), которые по отношению к железу выступают в роли катода (рис.
- 10. Электродный потенциал окисленного участка выше, чем неокисленного. Окисленные участки выполняют функцию катода. Так, например, если на
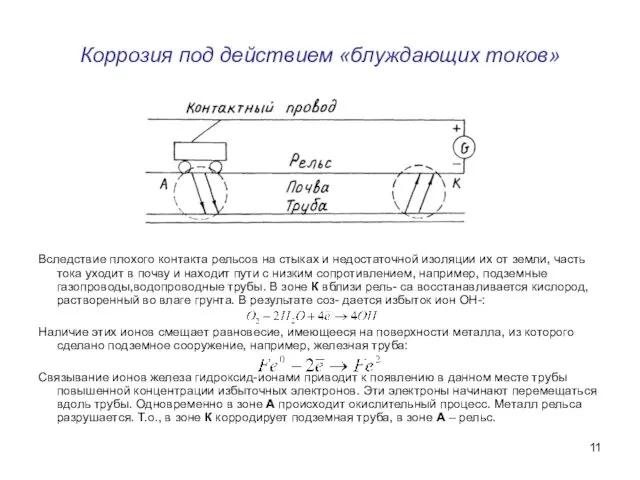
- 11. Коррозия под действием «блуждающих токов» Вследствие плохого контакта рельсов на стыках и недостаточной изоляции их от
- 12. Защита от коррозии
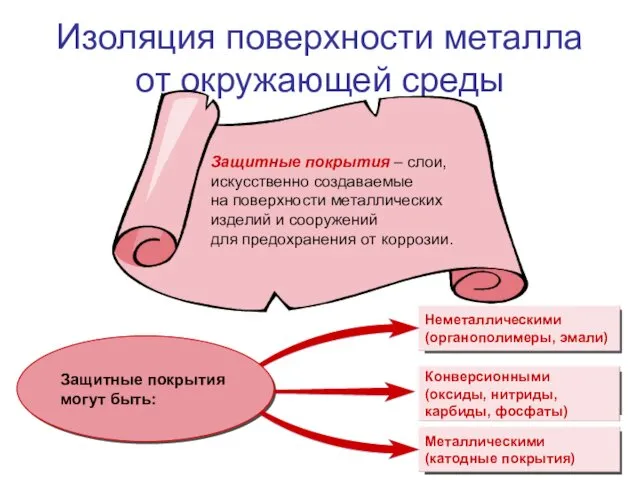
- 13. Все методы защиты металлов от коррозии условно делят на следующие группы: изоляция поверхности металла от окружающей
- 14. Изоляция поверхности металла от окружающей среды
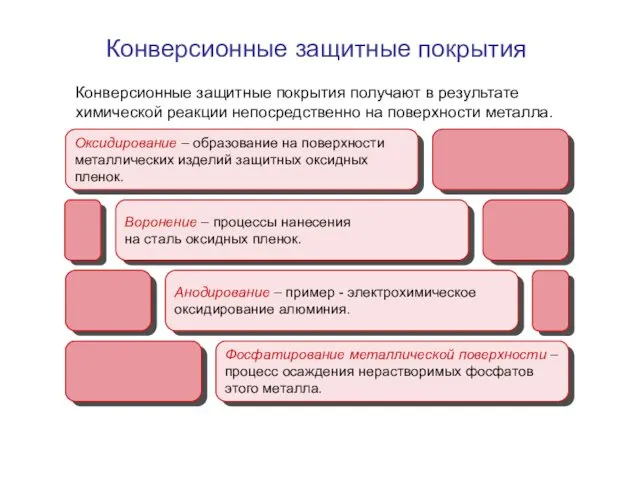
- 15. Конверсионные защитные покрытия получают в результате химической реакции непосредственно на поверхности металла. Конверсионные защитные покрытия
- 16. Металлические защитные покрытия. Катодные покрытия Катодные защитные покрытия – это покрытия металлом, электродный потенциал которого в
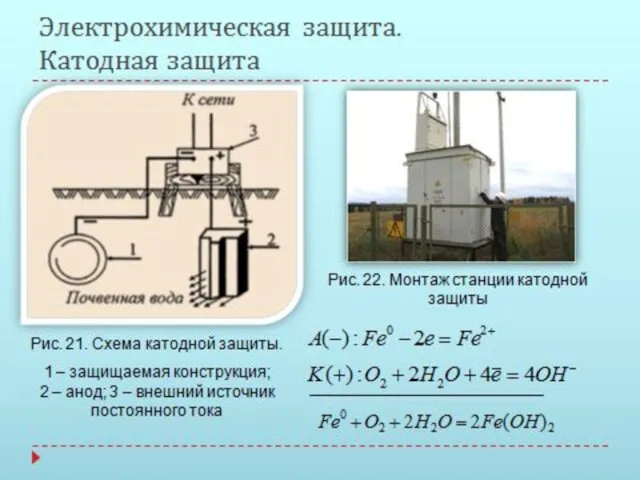
- 17. Электрохимическая защита. Анодные металлические покрытия
- 18. Протекторная защита Схема протекторной защиты Анод (Ме-протектор): Катод (Ме трубы) : ( среда – кислая )
- 21. Скачать презентацию












 Влияние загрязнения окружающей среды на здоровье
Влияние загрязнения окружающей среды на здоровье Презентация к уроку: Горные породы и минералы
Презентация к уроку: Горные породы и минералы Химия воздействия курения, алкоголя и наркотиков на организм. Лекция №4
Химия воздействия курения, алкоголя и наркотиков на организм. Лекция №4 Диктатический материал, используемый на занятиях по автоматизации слогослияния.
Диктатический материал, используемый на занятиях по автоматизации слогослияния. Бытовая химия
Бытовая химия История Тихвинского вагоностроительного завода
История Тихвинского вагоностроительного завода Онкология. Отличия доброкачественных опухолей от злокачественных
Онкология. Отличия доброкачественных опухолей от злокачественных Центр тестирования ВФСК ГТО Металлург
Центр тестирования ВФСК ГТО Металлург Конфликты и их природа
Конфликты и их природа Методика преподавания орфографии
Методика преподавания орфографии Презентация к уроку краеведение. Тема: По заповедным тропам Республики Коми
Презентация к уроку краеведение. Тема: По заповедным тропам Республики Коми Алкогольный синдром плода
Алкогольный синдром плода Женские пальто от производителя. Предложение о сотрудничестве для торговых центров
Женские пальто от производителя. Предложение о сотрудничестве для торговых центров Презентация Мы и наше здоровье
Презентация Мы и наше здоровье Презентация Черепаха
Презентация Черепаха Теоретичні засади управління міжнародними каналами розподілу
Теоретичні засади управління міжнародними каналами розподілу Оперативті хирургиялық техниканын, заманауи инструменттедін негіздері
Оперативті хирургиялық техниканын, заманауи инструменттедін негіздері Индустриальное общество в начале XX века
Индустриальное общество в начале XX века Виды деятельности человека
Виды деятельности человека Ареал проживання. Міграції. Закономірності розміщення тварин
Ареал проживання. Міграції. Закономірності розміщення тварин презентация по теме: Организация совместной деятельности родителей и друзей
презентация по теме: Организация совместной деятельности родителей и друзей Центр социальной помощи Шаг вперед
Центр социальной помощи Шаг вперед Презентация к уроку Природные условия и ресурсы Восточной Сибири
Презентация к уроку Природные условия и ресурсы Восточной Сибири Правописание сочетаний жи-ши
Правописание сочетаний жи-ши Презентация по технологии 1 класс на тему Цепочка из бумаги
Презентация по технологии 1 класс на тему Цепочка из бумаги Ordo. Czyli, rzecz o zakonach
Ordo. Czyli, rzecz o zakonach Презентация Фетнәле еллар. А.А.Плешаков, 4 класс Диск
Презентация Фетнәле еллар. А.А.Плешаков, 4 класс Диск Стихи на уроках - 5
Стихи на уроках - 5