Содержание
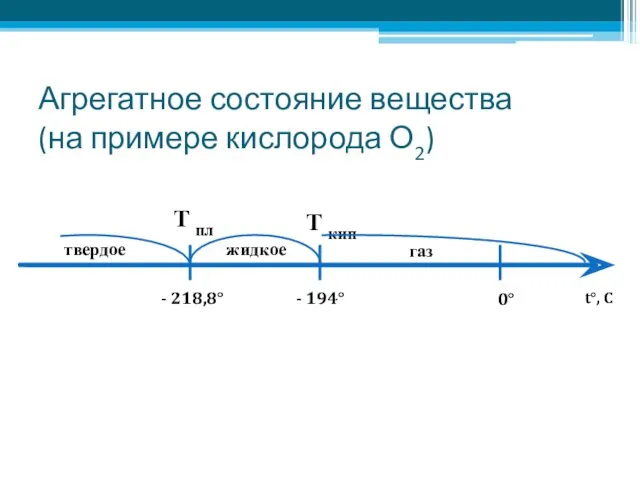
- 2. Агрегатное состояние вещества (на примере кислорода О2) - 218,8° - 194° 0° t°, C Т пл
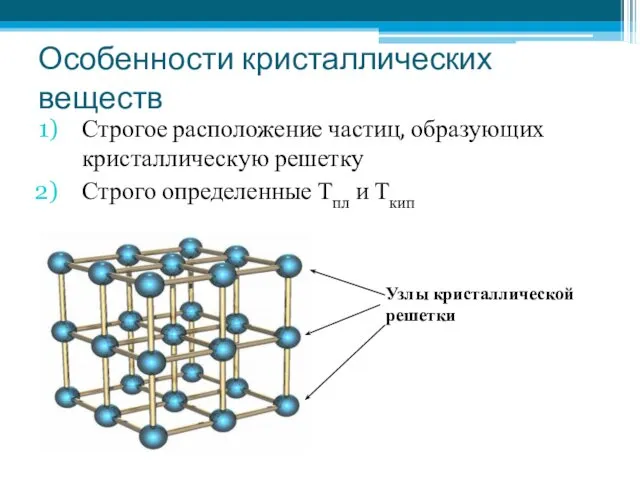
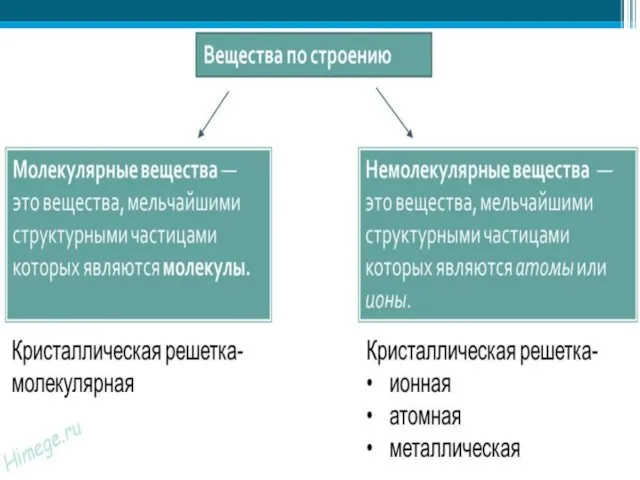
- 3. Особенности кристаллических веществ Строгое расположение частиц, образующих кристаллическую решетку Строго определенные Тпл и Ткип Узлы кристаллической
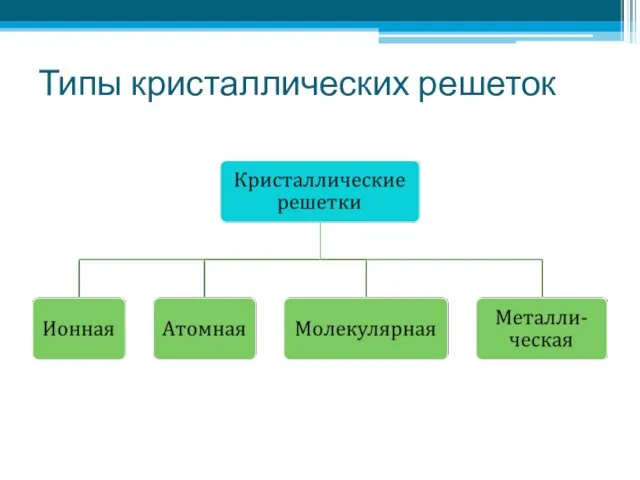
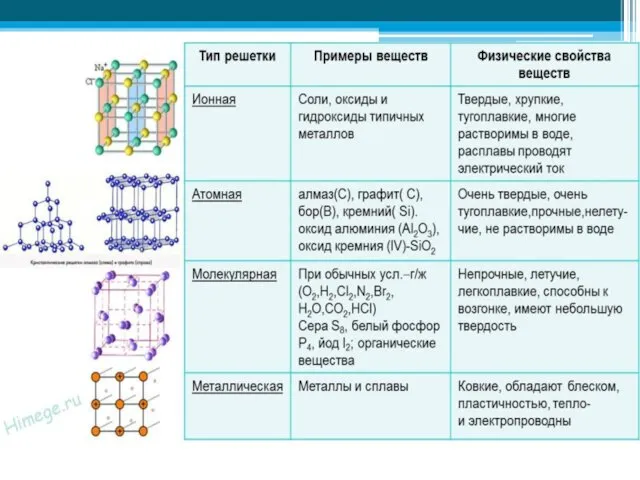
- 4. Типы кристаллических решеток
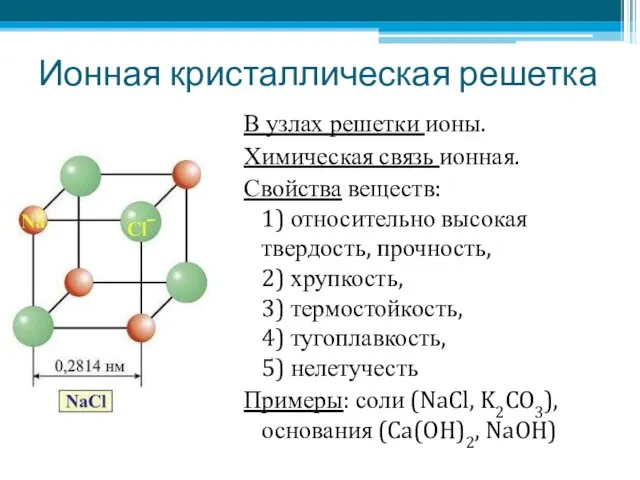
- 5. Ионная кристаллическая решетка В узлах решетки ионы. Химическая связь ионная. Свойства веществ: 1) относительно высокая твердость,
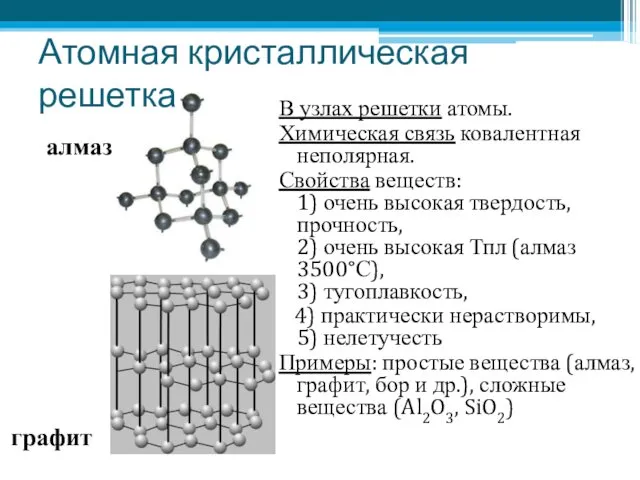
- 6. Атомная кристаллическая решетка В узлах решетки атомы. Химическая связь ковалентная неполярная. Свойства веществ: 1) очень высокая
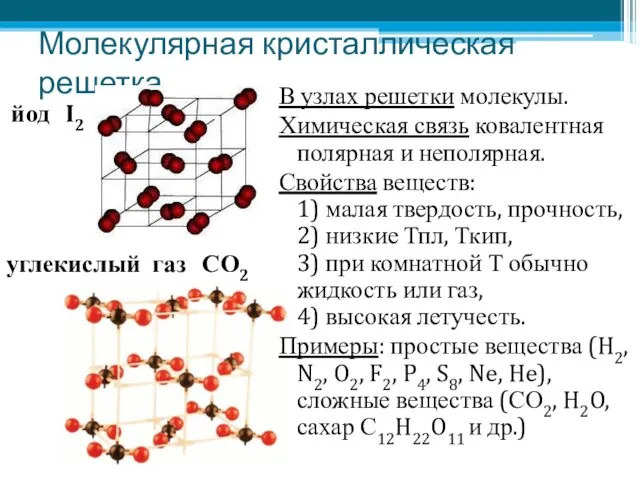
- 7. Молекулярная кристаллическая решетка В узлах решетки молекулы. Химическая связь ковалентная полярная и неполярная. Свойства веществ: 1)
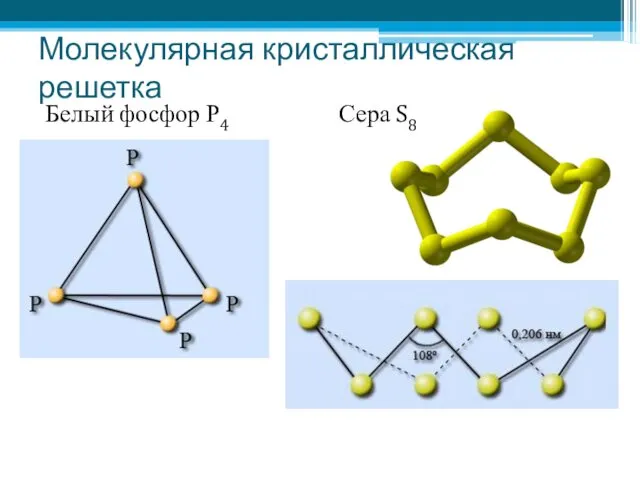
- 8. Молекулярная кристаллическая решетка Белый фосфор Р4 Сера S8
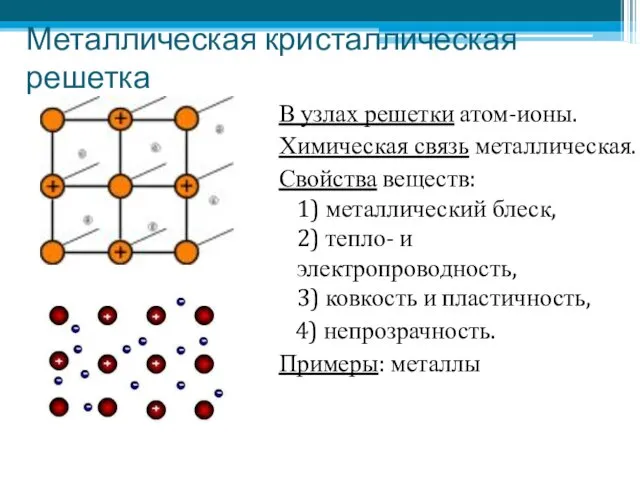
- 9. Металлическая кристаллическая решетка В узлах решетки атом-ионы. Химическая связь металлическая. Свойства веществ: 1) металлический блеск, 2)
- 10. Закон постоянства состава (Пруст, 1799-1803) Молекулярные химические соединения независимо от способа их получения имеют постоянный состав
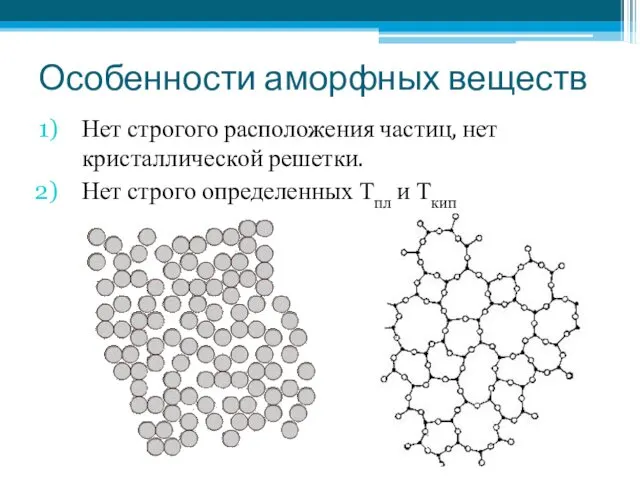
- 13. Особенности аморфных веществ Нет строгого расположения частиц, нет кристаллической решетки. Нет строго определенных Тпл и Ткип
- 14. Аморфные вещества
- 15. Аморфные вещества
- 16. Аморфные вещества
- 17. Аморфные вещества
- 18. Аморфные вещества
- 19. Аморфные вещества
- 20. Аморфные вещества
- 22. Скачать презентацию






 Содержание образования
Содержание образования Двугранный угол. Перпендикулярность плоскостей
Двугранный угол. Перпендикулярность плоскостей Праведный Иоанн Кронштадтский – воин духовный
Праведный Иоанн Кронштадтский – воин духовный Школьные годы чудесные
Школьные годы чудесные Современный урок
Современный урок Портфолио первоклассника
Портфолио первоклассника Презентация по теме Оксиды - оксид водорода
Презентация по теме Оксиды - оксид водорода Святой пророк Иеремия. По материалам дипломной работы протод
Святой пророк Иеремия. По материалам дипломной работы протод Антисоциальные и криминальные молодежные группы
Антисоциальные и криминальные молодежные группы Музей Боевой путь 12-й Приморской и 9-й Ленинградской партизанских бригад
Музей Боевой путь 12-й Приморской и 9-й Ленинградской партизанских бригад Презентация Из опыта работы по поддержке талантливой молодежи
Презентация Из опыта работы по поддержке талантливой молодежи Визитка моего класса
Визитка моего класса Парк им. А. Толстого. Город Брянск. Диск Диск Диск Диск
Парк им. А. Толстого. Город Брянск. Диск Диск Диск Диск Физкультминутка к уроку татарского языка Диск
Физкультминутка к уроку татарского языка Диск Образование и культура в XVII веке
Образование и культура в XVII веке Международные организации по стандартизации
Международные организации по стандартизации Тест по теме Мир глазами астронома
Тест по теме Мир глазами астронома Конфликтная компетентность. Содержание понятия, способы измерения и развития
Конфликтная компетентность. Содержание понятия, способы измерения и развития Центры образования цифрового и гуманитарного профилей Точка роста
Центры образования цифрового и гуманитарного профилей Точка роста Социокультурные факторы развития графического дизайна
Социокультурные факторы развития графического дизайна Оқу шеберханаларындағы практикум Тігін машиналарын қолдану және оның құрылу тарихы
Оқу шеберханаларындағы практикум Тігін машиналарын қолдану және оның құрылу тарихы Квест - игра Команда 6 Железногорск
Квест - игра Команда 6 Железногорск Соотношение акцентуаций характера и склонность к девиантности
Соотношение акцентуаций характера и склонность к девиантности цветы для мамы
цветы для мамы Картотека игр по экологии
Картотека игр по экологии Ожирение и избыточная масса тела
Ожирение и избыточная масса тела Эпоха дворцовых переворотов
Эпоха дворцовых переворотов Гремячая Грива
Гремячая Грива