Содержание
- 2. Особенность: абсолютный (безэталонный) метод анализа Достоинства метода: Прецизионность (Sr ≅ 0,005); Возможность определения как основных компонентов
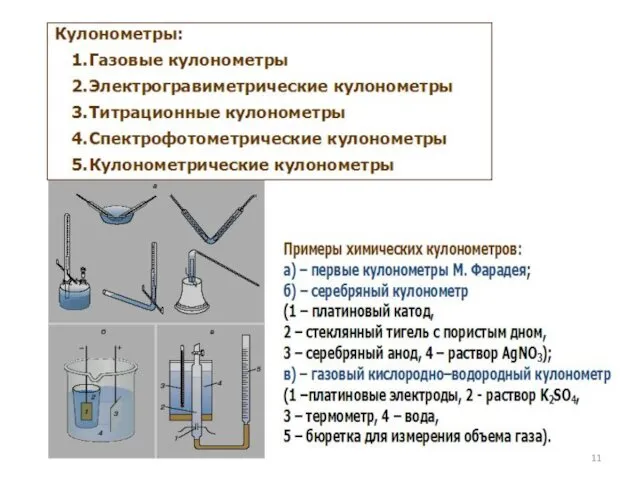
- 3. История возникновения метода Первые сведения об использовании электролиза в химическом анализе относятся еще к началу 19
- 4. Теоретические основы метода - законы электролиза ( М.Фарадей (Англия), 1833-1834 гг) Объединенный закон Фарадея: m=QM/nF m
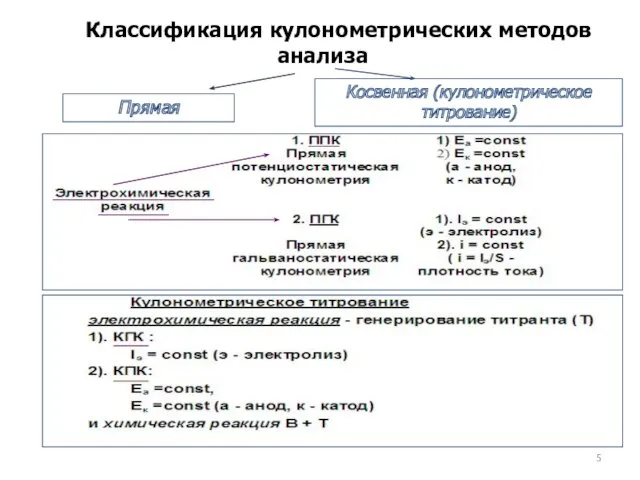
- 5. Классификация кулонометрических методов анализа Прямая Косвенная (кулонометрическое титрование)
- 6. m определяют по затраченному Q на электропревращение определяемого вещества (электроактивного) – прямая кулонометрия на электропревращение вспомогательного
- 7. При наложении Евнеш на ЭЯ в цепи возникает Iэ, а электроды приобретают Еа и Ек (
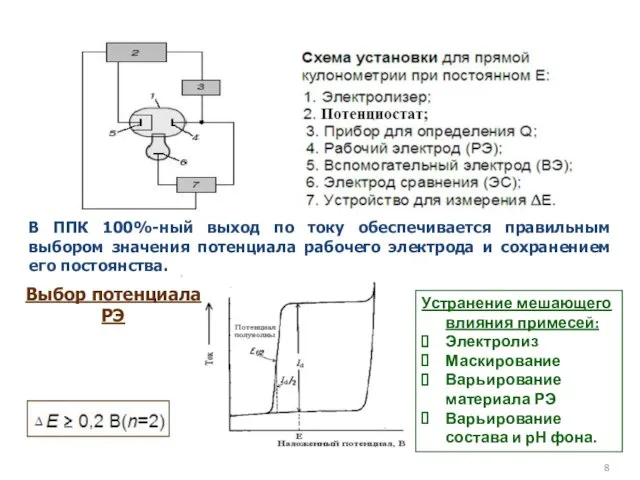
- 8. В ППК 100%-ный выход по току обеспечивается правильным выбором значения потенциала рабочего электрода и сохранением его
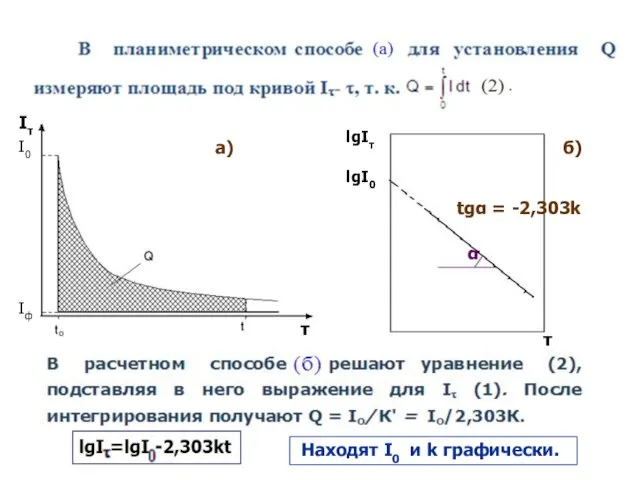
- 9. Определение количества электричества Электрохимическая реакция первого порядка:
- 10. I0 Iф lgI0 lgIτ tgα = -2,303k α Iτ τ τ а) б) Находят I0 и
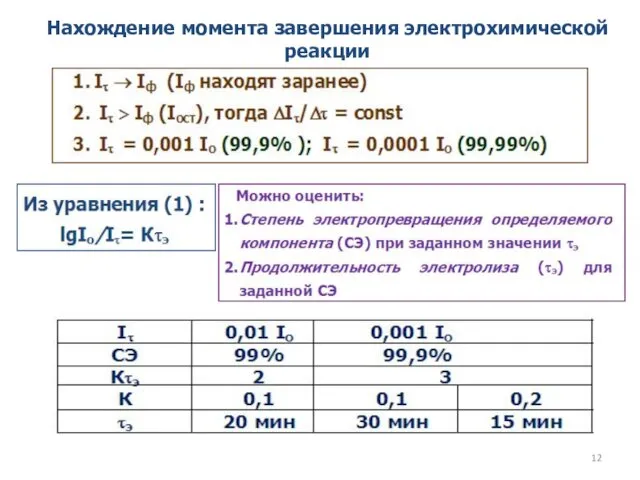
- 12. Нахождение момента завершения электрохимической реакции
- 13. Выбор условий проведения электролиза
- 14. К = 0,43DS/Vδ Время электролиза сокращается: Увеличение S/V Перемешивание раствора Нагревание раствора Замена растворителя
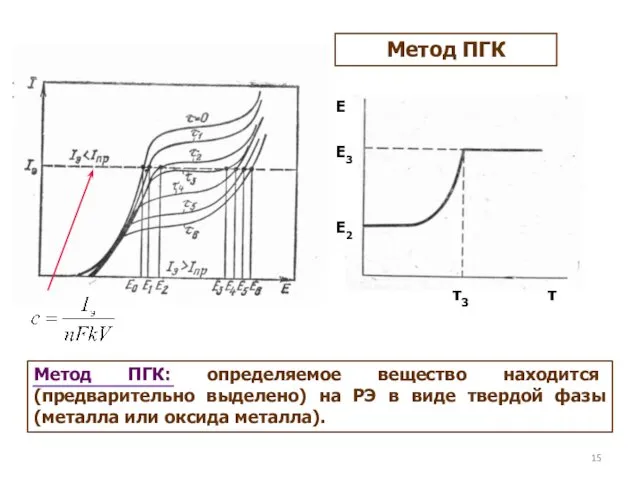
- 15. Метод ПГК E2 E3 E τ3 τ Метод ПГК: определяемое вещество находится (предварительно выделено) на РЭ
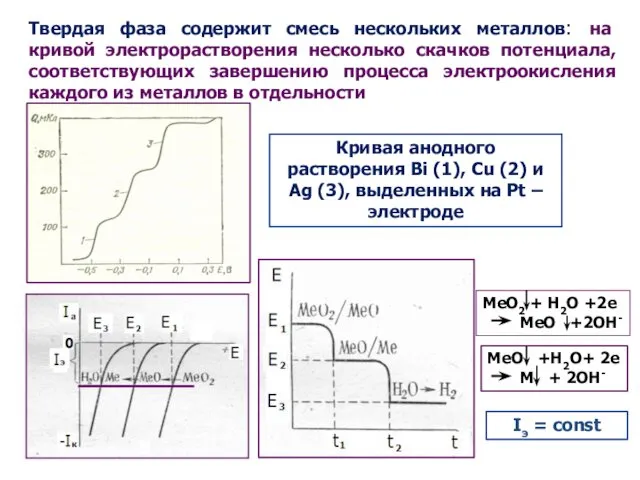
- 16. Твердая фаза содержит смесь нескольких металлов: на кривой электрорастворения несколько скачков потенциала, соответствующих завершению процесса электроокисления
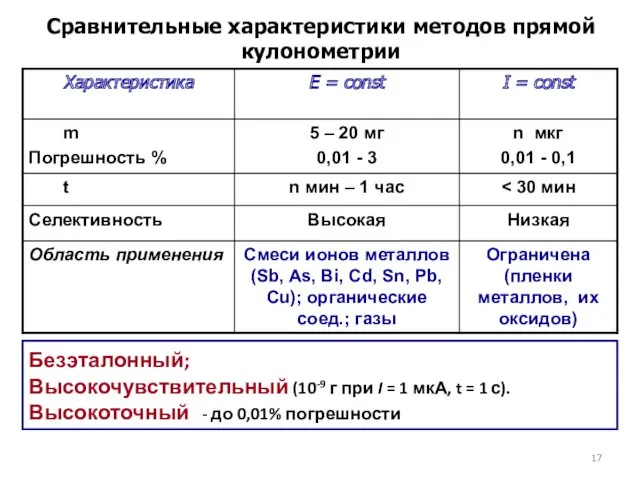
- 17. Сравнительные характеристики методов прямой кулонометрии Безэталонный; Высокочувствительный (10-9 г при I = 1 мкА, t =
- 18. Проблема обеспечения 100%-ного выхода по току
- 19. Косвенная кулонометрия (кулонометрическое титрование)
- 20. Косвенная кулонометрия с контролируемым потенциалом (КПК)
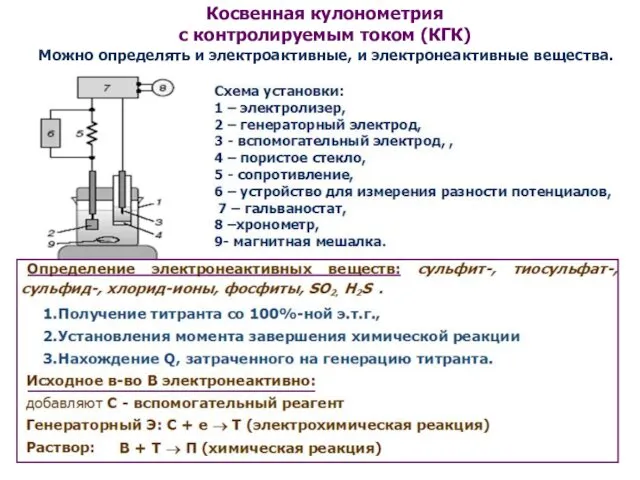
- 21. Косвенная кулонометрия с контролируемым током (КГК) Можно определять и электроактивные, и электронеактивные вещества.
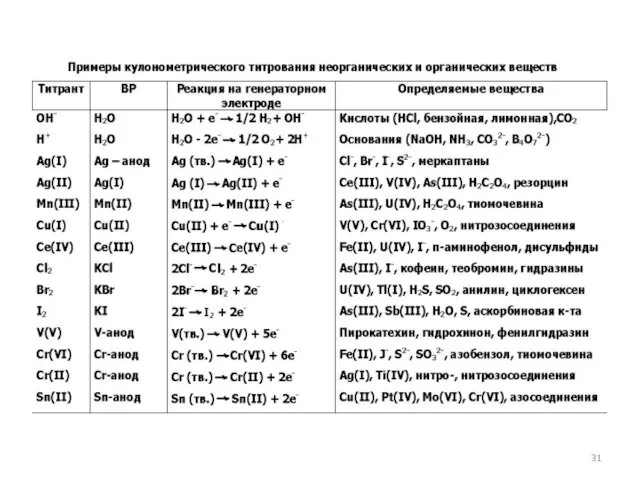
- 22. Определение электроактивных веществ: церия(IV), железа(II)
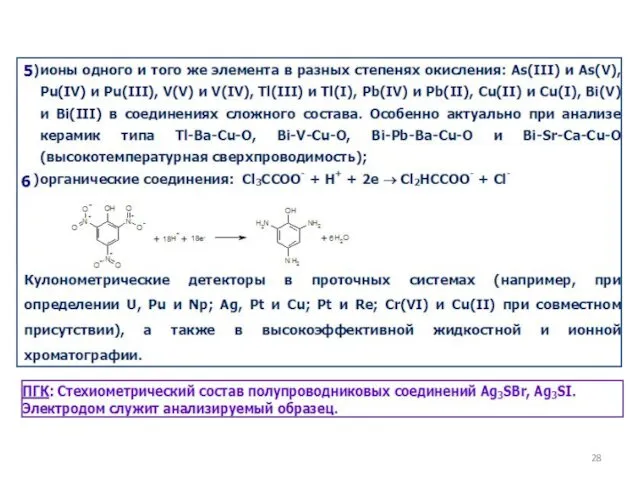
- 23. Современные направления
- 24. Требования к активному аноду: Должен иметь высокую коррозионную устойчивость по отношению к фоновым растворам; Должен легко
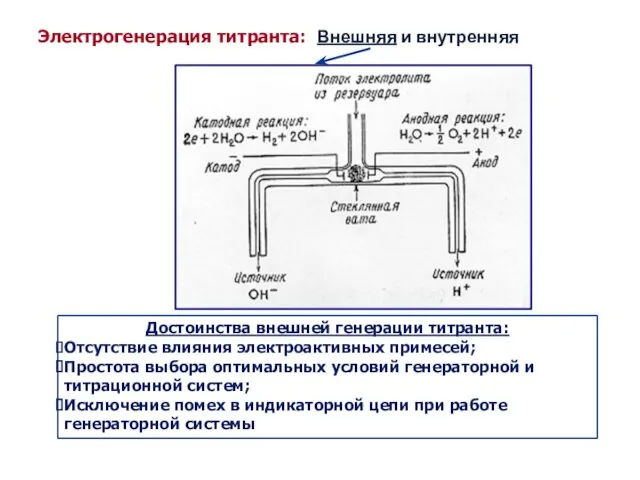
- 25. Электрогенерация титранта: Внешняя и внутренняя Достоинства внешней генерации титранта: Отсутствие влияния электроактивных примесей; Простота выбора оптимальных
- 26. Способы индикации конечной точки титрования Потенциометрия (ИСЭ, неполяризованные и поляризованные Э) Амперометрия (с одним и двумя
- 30. Современная аппаратура для кулонометрического титрования
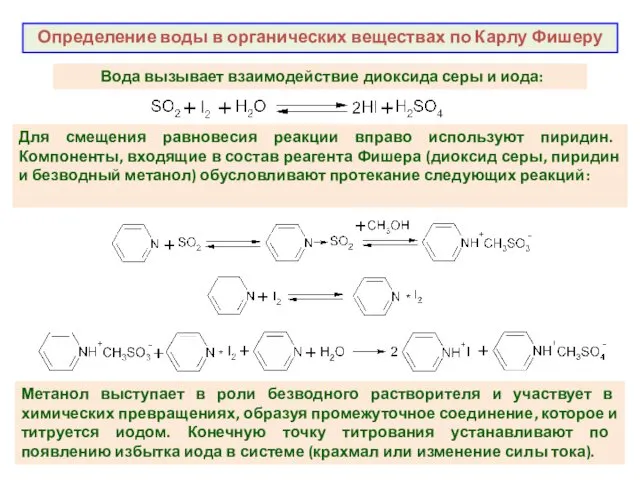
- 32. Определение воды в органических веществах по Карлу Фишеру Вода вызывает взаимодействие диоксида серы и иода: Для
- 33. Кулонометрический титратор для определения содержания воды по Фишеру Производство: Mettler Toledo, Швейцария Анализ образцов с содержанием
- 34. Автоматическое определение содержания воды по Фишеру Примеры применения: Содержание воды в полиуретанах Контроль качества полимеров (ПЭТФ)
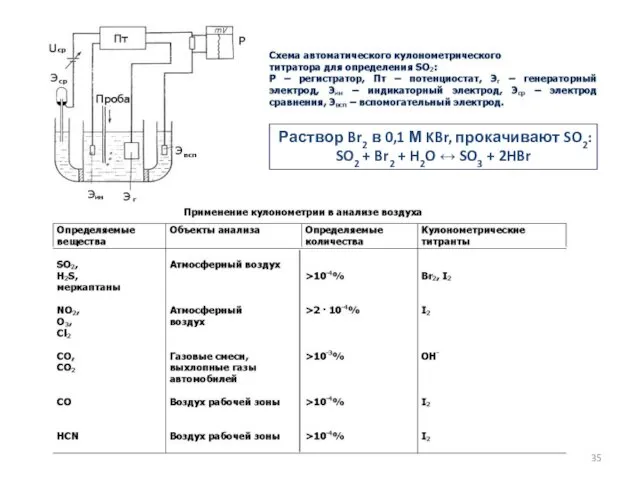
- 35. Раствор Br2 в 0,1 М KBr, прокачивают SO2: SO2 + Br2 + H2O ↔ SO3 +
- 37. Скачать презентацию




















 Профилактика инфекционных болезней и эпидемий
Профилактика инфекционных болезней и эпидемий Законы жизни семьи. Законы жизни класса.
Законы жизни семьи. Законы жизни класса. Рисование геометрических тел. Куб, призма и пирамида
Рисование геометрических тел. Куб, призма и пирамида Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение)
Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение) Биологическая игра Первый миллион
Биологическая игра Первый миллион Презентация по технологии Цветы из салфеток
Презентация по технологии Цветы из салфеток Холодильное оборудование
Холодильное оборудование Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него
Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него Разработка урока по теме население Алтайского края
Разработка урока по теме население Алтайского края Хранение информации
Хранение информации Презентация к уроку по теме Алкины. Строение, свойства, применение
Презентация к уроку по теме Алкины. Строение, свойства, применение Аналого-цифровые преобразователи. Метрология и теория измерений. Лекция 18
Аналого-цифровые преобразователи. Метрология и теория измерений. Лекция 18 Соединение проводов в распределительной коробке и на потребителе электроэнергии
Соединение проводов в распределительной коробке и на потребителе электроэнергии Подготовка к ОГЭ по географии, 9 класс
Подготовка к ОГЭ по географии, 9 класс Выявление и устройство детей, оставшихся без попечения родителей. Соотношение понятий устройство и воспитание
Выявление и устройство детей, оставшихся без попечения родителей. Соотношение понятий устройство и воспитание Кодирование и обработка числовой информации
Кодирование и обработка числовой информации Спирт этиловый
Спирт этиловый Историческая живопись
Историческая живопись Презентация по теме Цели и задачи проекта 1 класс Курс Учусь создавать проект Р. И. Сизова, Р. Ф. Селимова
Презентация по теме Цели и задачи проекта 1 класс Курс Учусь создавать проект Р. И. Сизова, Р. Ф. Селимова Қаттылықты анықтау тәсілдер
Қаттылықты анықтау тәсілдер Подготовка к краевым контрольным работам
Подготовка к краевым контрольным работам Реконструкция Калужского шоссе и развязки МКАД - Профсоюзная улица
Реконструкция Калужского шоссе и развязки МКАД - Профсоюзная улица Организация производственного и технологического процесса. Лекция 4
Организация производственного и технологического процесса. Лекция 4 IS-Passport. Автоматизация работы с миграционными службами
IS-Passport. Автоматизация работы с миграционными службами Гломерулонефриты у детей
Гломерулонефриты у детей Гибридизация
Гибридизация Противоэрозионная организация территории севооборотов ЗАО Ульяновский Ртищевского района Саратовской области
Противоэрозионная организация территории севооборотов ЗАО Ульяновский Ртищевского района Саратовской области Катализ. Цепные реакции. (Лекция 11)
Катализ. Цепные реакции. (Лекция 11)