Содержание
- 2. Что такое катализатор? Вещество, ускоряющее химическую реакцию, но само при этом не расходующееся ***Это не значит,
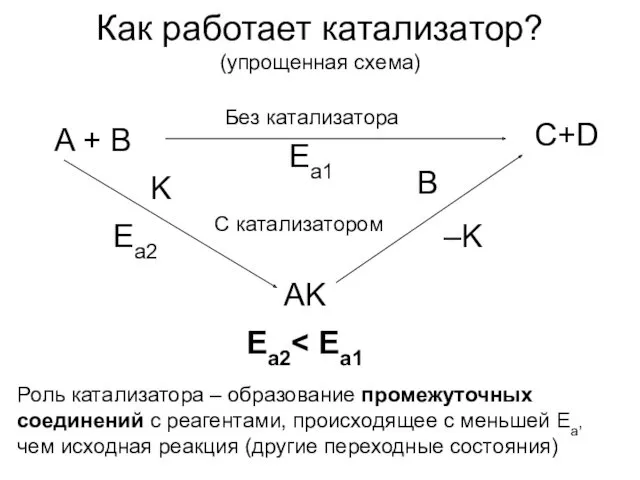
- 3. Как работает катализатор? (упрощенная схема) A + B С+D Без катализатора K AK B –K Роль
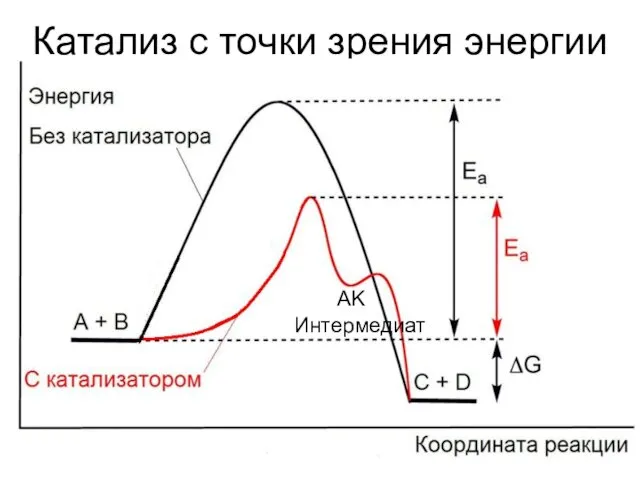
- 4. Катализ с точки зрения энергии AK Интермедиат
- 5. Важные замечания Катализатор одинаково ускоряет как прямую, так и обратную реакцию. Поэтому он не смещает химического
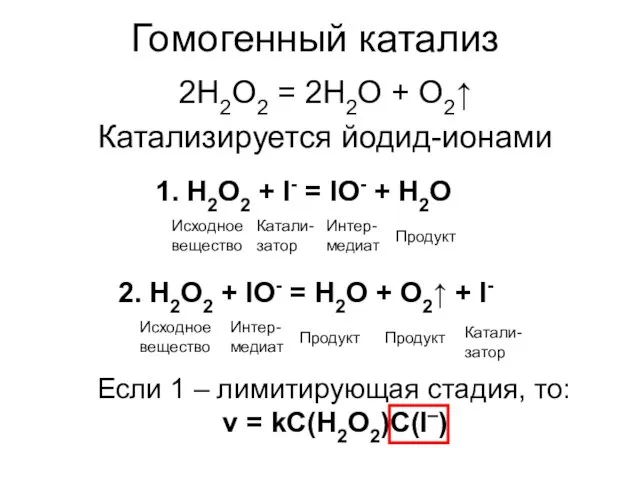
- 6. Гомогенный катализ 1. H2O2 + I- = IO- + H2O 2. H2O2 + IO- = H2O
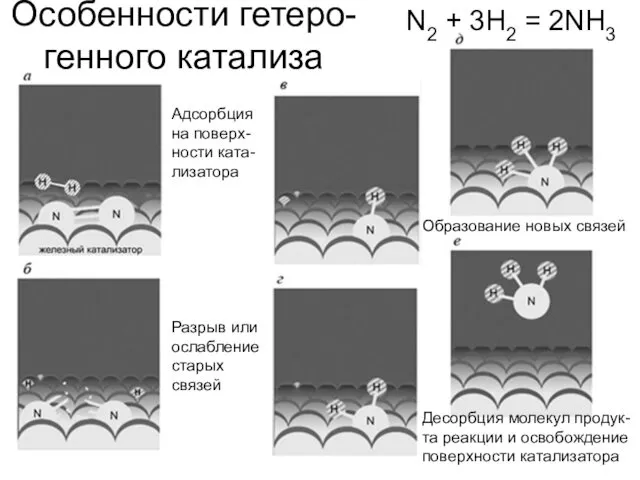
- 7. Особенности гетеро-генного катализа Адсорбция на поверх-ности ката-лизатора Разрыв или ослабление старых связей Образование новых связей Десорбция
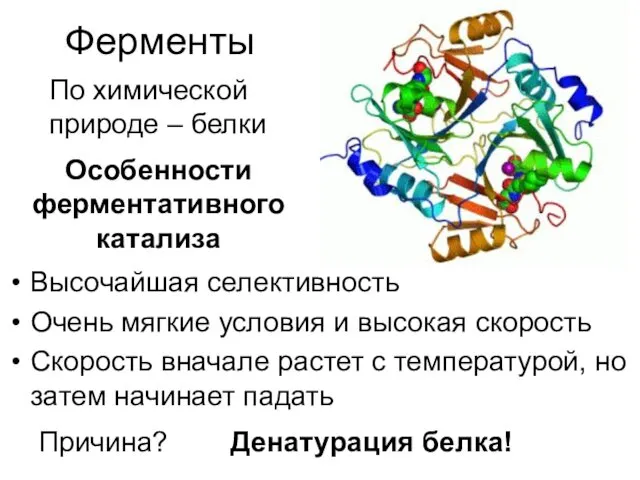
- 8. Ферменты Высочайшая селективность Очень мягкие условия и высокая скорость Скорость вначале растет с температурой, но затем
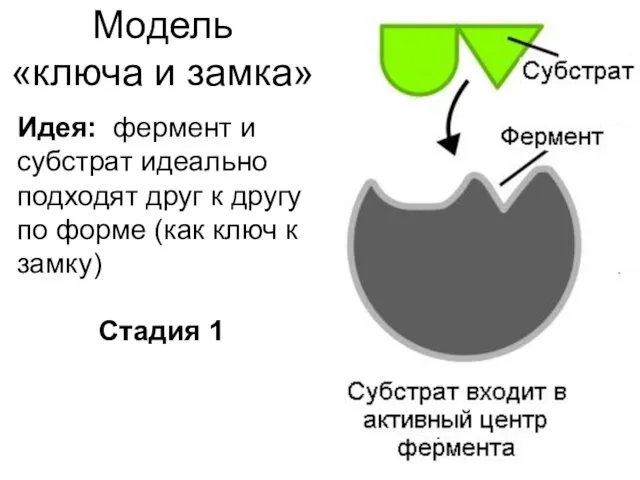
- 9. Модель «ключа и замка» Идея: фермент и субстрат идеально подходят друг к другу по форме (как
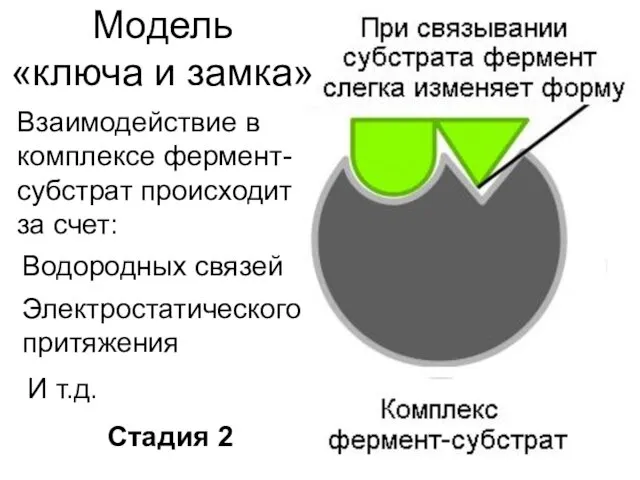
- 10. Модель «ключа и замка» Взаимодействие в комплексе фермент-субстрат происходит за счет: Стадия 2 Водородных связей Электростатического
- 11. Модель «ключа и замка» Продукты реакции слабее удерживаются в комплексе с ферментом, чем исходные вещества Стадия
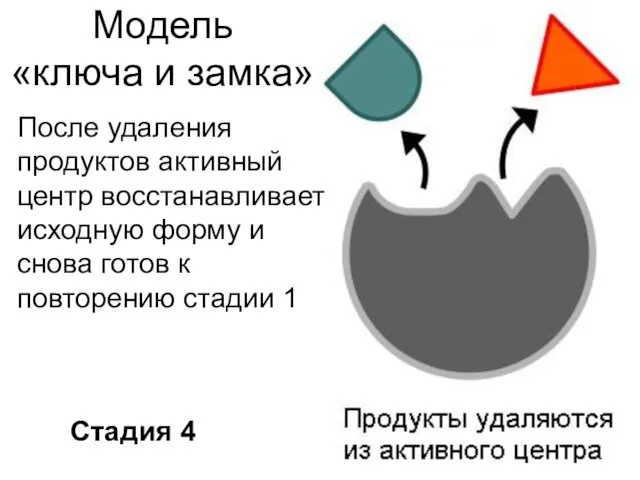
- 12. Модель «ключа и замка» Стадия 4 После удаления продуктов активный центр восстанавливает исходную форму и снова
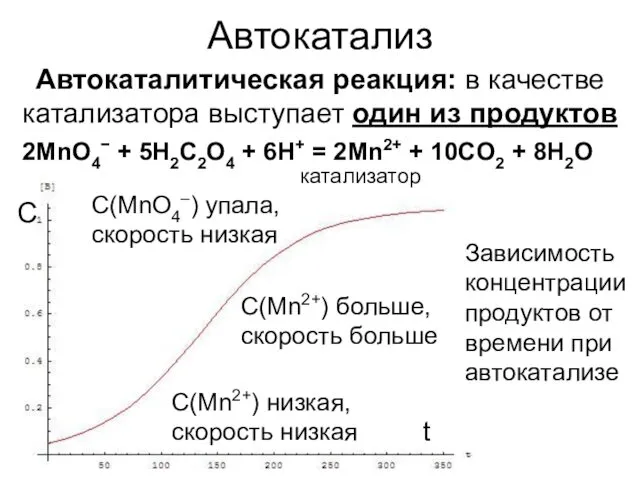
- 13. Автокатализ Автокаталитическая реакция: в качестве катализатора выступает один из продуктов 2MnO4− + 5H2C2O4 + 6H+ =
- 14. Цепные реакции Изучены Н.Семеновым и Р.Хиншелвудом в 30-е годы ХХ века на примере окисления паров белого
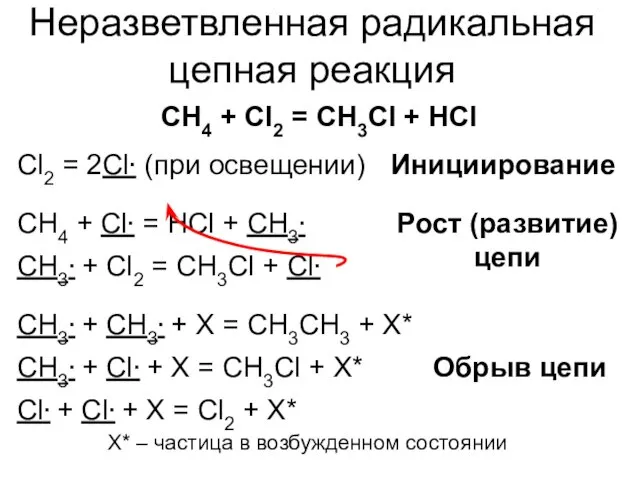
- 15. Неразветвленная радикальная цепная реакция CH4 + Cl2 = CH3Cl + HCl Cl2 = 2Cl∙ (при освещении)
- 17. Скачать презентацию




 Культура арабо-мусульманского мира
Культура арабо-мусульманского мира Животные мира
Животные мира 7 чудес Амурской области
7 чудес Амурской области VLAN. Технологии защиты сетей. Иерархическая сегментация трафика для изоляции портов
VLAN. Технологии защиты сетей. Иерархическая сегментация трафика для изоляции портов Физика - наука о природе
Физика - наука о природе Решетка металлическая для оконного проёма. Приложение к техническому заданию
Решетка металлическая для оконного проёма. Приложение к техническому заданию Непрерывные функции и точки разрыва
Непрерывные функции и точки разрыва Мастер-класс.Учимся писать синквейн. Мастер-класс на конкурсе Учитель года 2015
Мастер-класс.Учимся писать синквейн. Мастер-класс на конкурсе Учитель года 2015 Определение расчетных расходов дождевого стока
Определение расчетных расходов дождевого стока DRAM Tutorial
DRAM Tutorial Альдегиды, их химические и физические свойства
Альдегиды, их химические и физические свойства Анализ актуальности
Анализ актуальности Wikipedia. How it works and why it works
Wikipedia. How it works and why it works Энергоэффективные и энергосберегающие технологии и оборудования в производственной сфере и быту
Энергоэффективные и энергосберегающие технологии и оборудования в производственной сфере и быту Деисус. Первая треть XIII в. Из Успенского собора Московского Кремля. Государственная Третьяковская галерея
Деисус. Первая треть XIII в. Из Успенского собора Московского Кремля. Государственная Третьяковская галерея Проект Легкий шаг. Номинация Семейно-патриотическое воспитание
Проект Легкий шаг. Номинация Семейно-патриотическое воспитание Институциональные основы функционирования рыночной экономики
Институциональные основы функционирования рыночной экономики Положительные качества человека. Знакомство с понятием толерантности.
Положительные качества человека. Знакомство с понятием толерантности. Праздник осени,3 класс
Праздник осени,3 класс Игра Крестики-нолики
Игра Крестики-нолики Пирамида. Усеченная и правильная пирамиды. Тетраэдр
Пирамида. Усеченная и правильная пирамиды. Тетраэдр Портфолио учащегося как один из этапов перехода на новые стандарты.
Портфолио учащегося как один из этапов перехода на новые стандарты. Просеиватели муки для предприятий хлебопекарного и кондитерского производства
Просеиватели муки для предприятий хлебопекарного и кондитерского производства Методические указания к выполнению выпускной квалификационной работы для студентов. Профиль Бурение нефтяных и газовых скважин
Методические указания к выполнению выпускной квалификационной работы для студентов. Профиль Бурение нефтяных и газовых скважин Владимир Святой (Красно Солнышко, Креститель) 980 – 1015 гг
Владимир Святой (Красно Солнышко, Креститель) 980 – 1015 гг Оборудование для транспортирования и хранения сырья
Оборудование для транспортирования и хранения сырья Презентация к уроку химии в 10 классе Строение и химические свойства глюкозы.
Презентация к уроку химии в 10 классе Строение и химические свойства глюкозы. Декартовы прямоугольные координаты на плоскости и в пространстве
Декартовы прямоугольные координаты на плоскости и в пространстве