Содержание
- 2. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 План лекции
- 3. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Ключевые понятия
- 4. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Историческая справка
- 5. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Функции гемоглобина
- 6. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Состав гемоглобина
- 7. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Состав гемоглобина Состав полипептидных цепей в гемоглобине изменяется в
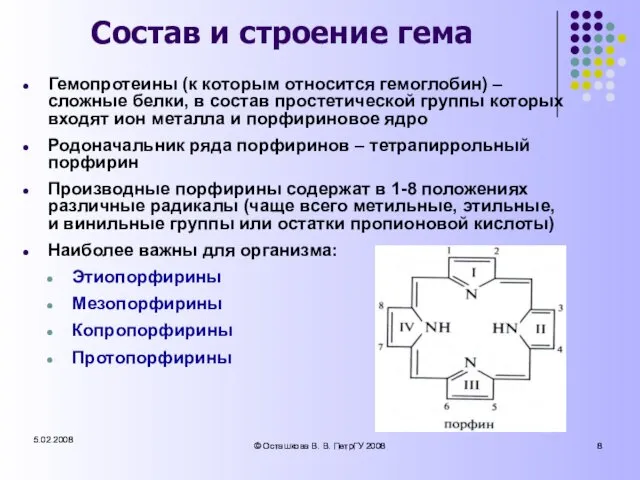
- 8. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Состав и
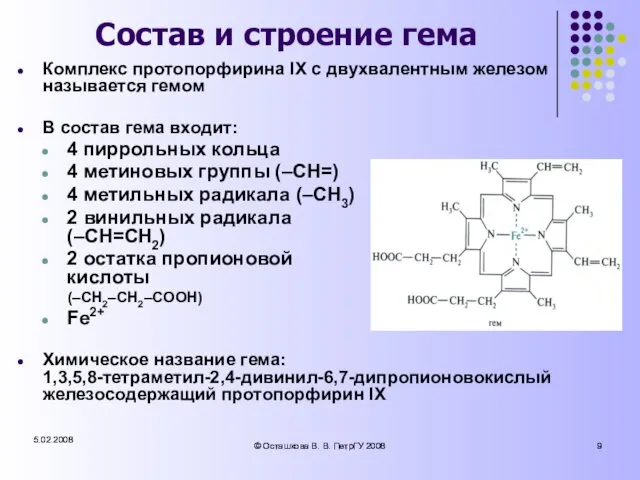
- 9. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Состав и
- 10. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Состав и
- 11. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Строение полипептидных
- 12. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Полиморфизм гемоглобинов
- 13. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Функционирование гемоглобина
- 14. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Функционирование гемоглобина
- 15. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Функционирование гемоглобина
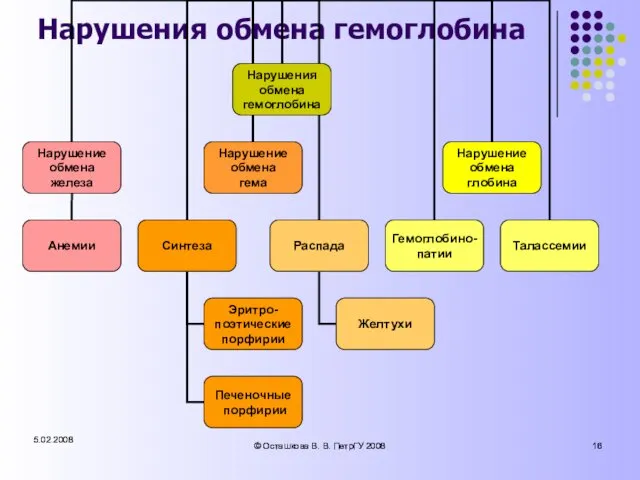
- 16. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Нарушения обмена
- 17. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Порфирии Причиной первичных порфирий являются наследственные дефекты ферментов, участвующих
- 18. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Нарушение распада гемоглобина Распад гемоглобина начинается в РЭС Сначала
- 19. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Желтухи В норме содержание общего билирубина в крови в
- 20. 5.02.2008 © Осташкова В. В. ПетрГУ 2008 Гемоглобинозы Гемоглобинозы – заболевания, обусловленные нарушением синтеза белковой части
- 22. Скачать презентацию
















 Фотоальбом. Машенька
Фотоальбом. Машенька Международные и региональные торговые сети
Международные и региональные торговые сети Презентация к уроку Деление клетки. Митоз. естествознание-5 класс
Презентация к уроку Деление клетки. Митоз. естествознание-5 класс символы и эмблемы
символы и эмблемы Шаблоны презентаций - 5
Шаблоны презентаций - 5 Окна. Оконные проёмы. Варианты оформления
Окна. Оконные проёмы. Варианты оформления Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении
Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении G`alamat online school
G`alamat online school Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф
Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5)
Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5) דור המייסדים - יונג ואדלר
דור המייסדים - יונג ואדלר Виды перевозок пассажиров автомобильным транспортом
Виды перевозок пассажиров автомобильным транспортом Бактериялар
Бактериялар Всемирный день без табака
Всемирный день без табака Функции рекламы и PR в организации
Функции рекламы и PR в организации Обустройство морских нефтегазовых месторождений
Обустройство морских нефтегазовых месторождений Основные теоремы магнитостатического поля
Основные теоремы магнитостатического поля Внутренние воды РТ
Внутренние воды РТ Генеральный план
Генеральный план prezentatsia
prezentatsia Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области
Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия
Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия Современные технологии на уроках географии
Современные технологии на уроках географии Презентация Лоскутное шитье-неиссякаемый источник творчества
Презентация Лоскутное шитье-неиссякаемый источник творчества Гальваностегія. Приклад гальванізації сріблом (або золотом)
Гальваностегія. Приклад гальванізації сріблом (або золотом) Презентация День семьи
Презентация День семьи Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках
Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках Внутренние воды Пензенской области
Внутренние воды Пензенской области